Schwarzwasser – Chemie, Ökologie, Physiologie & Mikrobiologie
Marc Gregor Mohr
Vorwort
Egal ob Schmetterlingsbuntbarsche, Rote Neons, Laubkampffische oder Moskitobärblinge, überall in den Tropen dieser Welt finden sich prachtvolle Fischarten unterschiedlicher Größe mit leuchtendem Schuppenkleid. Es sind besonders diese Arten, die Aquarianer stets begeisterten und faszinierten. Doch eben jene Arten stammen oft aus vergleichsweise dunklen Biotopen, dem Schwarzwasser. Schon seit Jahren ahmen Aquarianer unter Zuhilfenahme moderner Technik aufwändig die Heimatgewässer ihrer Pfleglinge nach, um diese erfolgreich halten und vermehren zu können. Denn es sind auch eben jene, aus dem Schwarzwasser stammenden, Fischarten, die für ihre Empfindlichkeit bekannt sind.
In den letzten Jahren hat die Schwarzwasser-Aquaristik einen regelrechten Boom erlebt. Biotopnahe und "artgerechte" Haltung erhält in den Medien einen immer größeren Stellenwert. Schnell wird von essentiellen Huminstoffen, speziell angepassten osmotischen Drücken und Keimarmut gesprochen. Doch man sollte nicht alles in den Online- und Print-Medien glauben.
In diesem Artikel sollen nicht die Chemie oder die Technik zur Veränderung des Aquarienwassers im Vordergrund stehen. Dazu gibt es bereits einiges an Literatur. Auch die akute Krankheitsbehandlung steht hier nicht im Fokus. Stattdessen möchte ich als Natur- und Biowissenschaftler versuchen in diesem Artikel die Schnittstelle zwischen der Chemie des Aquarienwassers und der Gesundheit des Fisches im Schwarzwasser auf Grundlage wissenschaftlicher Publikationen skizzieren. Dabei versuche ich die Grundlagen der (Gewässer-)Ökologie, Tierphysiologie und Mikrobiologie zu vermitteln, um der Bedeutung der Wasserwerte auf den Grund gehen zu können.1. Schwarzwasser
1.1. Chemische Beschaffenheit
Die Binnengewässer Südamerikas werden in verschiedene Gewässertypen unterteilt. Je nach herangezogenen Kriterien lassen sich Gewässer unterschiedlich einteilen. So spielt bspw. der Nährstoffgehalt einen entscheidenden Einfluss und führt zu der Einteilung von oligotrophen (nährstoffarmen), mesotrophen (mäßig nährstoffreichen) und eutrophen (sehr nährstoffreichen) Gewässern. Hinsichtlich der gelösten Mineralien, des Nährstoffgehalts, Farbe und Trübung sowie pH-Wert und Anteil an gelöstem organischen Kohlenstoff lassen sich die Gewässer Südamerikas in drei verschiedene Gewässertypen einteilen; Klarwasser, Weißwasser und Schwarzwasser. Diese Einteilung, die vor allem auf den optischen Charakteristika der Gewässer beruhte, wurde von dem deutschen Biologen und Tropenökologen Harald Sioli, ehemaliger Direktor des Max-Planck-Instituts für Limnologie in Plön, 1950 beschrieben (Furch 1984).
Doch auch in ihrer chemischen Zusammensetzung unterschieden sich diese drei Gewässertypen drastisch (siehe Tabelle 1). Weißwasser ist reich an Trübstoffen, hervorgerufen durch mineralische Schwebstoffe. Es enthält, verglichen mit den anderen beiden Gewässertypen, viele Mineralien und ist demnach reich an Ionen. Zudem ist es sauerstoffreich mit einem leicht sauren oder neutralen pH-Wert. Die Sichtweite Unterwasser beschränkt sich auf wenige Zentimeter. Die Gesamt- und Karbonathärte variieren je nach Gewässer und Jahreszeit zwischen 1 bis >10°dH. Klarwasser hingegen ist frei von Trübstoffen und besitzt keine offensichtliche Wasserfärbung. Hier beträgt die Sichtweite bis zu 4 Meter. Der pH-Wert liegt häufig im sauren Bereich, oftmals zwischen 4,5 und 6,5. Gesamt- und Karbonathärte liegen bei etwa 1°dH. Große Unterschiede hinsichtlich der chemischen Parameter haben Klarwasser- und Schwarzwasser-Biotope im Fluss-System des Orinoko nicht. In den subtropischen Regionen, wie beispielsweise dem Rio Paraguay und dem Rio Uruguay ähnelt das Klarwasser eher dem Weißwasser, da hier eine Karbonathärte >4°dH und ein pH >7,5 nachgewiesen wurden. Schwarzwasser weist keine Trübung auf, jedoch ist die Sichtweite hier ebenfalls auf einige Zentimeter bis 2 Meter beschränkt aufgrund der bernsteinfarbenen bis „Cola-farbenen“ Färbung. Hervorgerufen wird diese Farbe durch große Mengen an gelöstem organischen Kohlenstoff, kurz DOC (dissolved organic carbon), der sich vor allem aus Humin- und Gerbstoffen zusammensetzt. Die in diesen Wässern enthaltenen Huminstoffe und Gerbsäuren säuern das Wasser stark an, sodass der pH-Wert häufig bei 3,8 bis 5,5 liegt. Abgesehen von den sauren Oxoniumionen (H3O+) ist Schwarzwasser sehr ionenarm.
Einer der wohl bekanntesten Schwarzwasser-Flüsse Südamerikas ist der Rio Negro. Nach einer indigenen Legende entspringt der Rio Negro in einem See in den entlegenen Vorgebirgen. Dort badet einmal im Jahr der pechschwarze Geist des Bösen, Daipurui, um sich von den großen Zecken zu befreien, die er sich beim Reiten auf Tapiren durch den Dschungel in der Dämmerung einfängt. Es sei der Schmutz, so sagt man, der sich bei diesen jährlichen Waschungen von seinem Körper löst und den Rio Negro schwarz färbt (MacCreagh 2001). Heute weiß man, dass es die humusreichen Böden sind, die den Fluss mit Huminstoffen anreichern.
| Gewässertyp | Charakteristika |
|---|---|
| Klarwasser | Klar, leichte olivgrüne Färbung des Wassers, mineralarm mit häufig leicht saurem pH. Sichtweite bis zu 4 Meter. Beispiel; Rio Tapajos |
| Weißwasser | Lehmgelbes oder milchig trübes Aussehen hervorgerufen durch mineralische Schwebstoffe. Sichtweite; wenige Zentimeter. Beispiel; Rio Solimoes |
| Schwarzwasser | Klares, teefarbenes Wassers. Extrem mineralarm und sehr sauer mit pH-Werten zwischen 3,8 und 5,5. Sichtweite variiert je nach Konzentration an Humin- und Gerbstoffen. Beispiel; Rio Negro |
Die unterschiedlichen Ionenkompositionen dieser Gewässer und ihre jahreszeitlichen Schwankungen haben sich in den vergangenen Jahrzehnten verschiedene Wissenschaftler dokumentiert und erforscht. Karin Furch beschrieb die Unterschiede der Weiß- und Schwarzwasser-Biotope Amazoniens im Jahre 1984. Sie nahm in den Jahren von 1974 bis 1976 monatlich Wasserproben und untersuchte diese hinsichtlich ihrer chemischen Zusammensetzung in Plön. Für die Regenwaldflüsse und das Regenwasser wurden jedoch nur zwei Proben genommen, im Oktober 1975 während der Trockenzeit, und im März 1976 während der Regenzeit.
Weiß- und Schwarzwasser enthalten mit 10 – 20 mg/L etwa ähnlich viel Kohlenstoff, jedoch unterscheiden sich die Anteile der Kohlenstoffquellen. In Weißwasser-Flüssen wie dem Rio Solimoes machen Carbonate (HCO3- , CO32-) etwa 50% des gesamten Kohlenstoffs aus. In Schwarzwasser-Flüssen wie dem Rio Negro machen anorganische Kohlenstoffverbindungen wie Carbonate nur einen marginalen Teil des gesamten Kohlenstoffs aus, da dieser vor allem aus den gelösten organischen Verbindungen besteht. Weißwasser enthält in der Regel deutlich mehr Silikat (bis ~4 mg/L), Phosphat (bis ~0,1 mg/L) und Sulfat als Schwarzwasser. Der Anteil an Chlorid-Anionen in Weiß- und Schwarzwasser ist hingegen vergleichbar hoch und schwankt in verschiedenen Flüssen des Amazonasbeckens zwischen 1,7 und 3,1 mg/L (Furch 1984).
Schwarzwasser ist zwar sehr ionenarm, enthält jedoch auffällig viele Spurenelemente. Im Vergleich zu Weißwasser wie dem Rio Solimoes enthält Schwarzwasser wie bspw. aus dem Rio Negro mindestens genauso viel oder gar mehr Eisen, Kupfer, Mangan und Zink.
Als Carbonatwasser enthält Weißwasser vor allem viele Calciumkationen. Im Rio Solimoes sind es durchschnittlich 5,7 mg/L. Hinzu kommen etwa 2 mg/L Natrium und jeweils etwa 1 mg/L Kalium und Magnesium. Im Schwarzwasser des Rio Negro sind die Mengen der Kationen deutlich reduziert. Es enthält nur 0,2 mg/L Calcium und 0,4 mg/L Natrium (siehe Abbildung 1).
Ein weiterer wesentlicher Unterschied zwischen Schwarz- und Weißwasser-Biotopen, abseits der absoluten Ionenhäufigkeit, besteht offensichtlich in der Verteilung der Alkali- und Erdalkalimetall-Kationen. Während Weißwasser zu etwa 70% aus den Erdalkalimetallionen Magnesium und insbesondere Calcium besteht, dominieren im Schwarzwasser mit etwa 70% die Alkalimetalle Natrium und Kalium gleichermaßen (siehe Abbildung 2).
Genaue Daten zu den saisonalen Schwankungen der im Wasser gelösten Alkali- und Erdalkalimetallionen existieren derzeit nicht. Allard et al. 2011 berichteten, dass der pH-Wert in Schwarzwasser-Gewässern des Amazonasbeckens während der Trockenzeit auf bis zu 5,5 ansteigt, während der Regenzeit jedoch nicht einen Wert von 4,7 überschreitet. Die strikte Trennung dieser drei Gewässertypen gelingt nur auf dem Papier. In der Realität lassen sich wahrscheinlich diverse Mischformen finden, wie beispielsweise in den vielen Schwarzwasser-Bächen, die in der Nähe größerer Weißwasser-Flüsse liegen. Im Oktober 2002, am Ende der Trockenzeit mit der geringsten Niederschlagsmenge, wurden in einem solchen Schwarzwasserbach, dem Rio Badajós, der neben dem Rio Solimoes verläuft, durchschnittlich 2,44 mg/L Ca2+, 0,32 mg/L Na+, 0,51 mg/L K+, 0,48 mg/L Mg2+ und 4,72 mg/L Cl- bei einem pH 5,5 gemessen (Horbe & Santos 2009). Der Weißwasser-Eintrag in diese Schwarzwasserbäche während der Regenzeit sorgt für starke jahreszeitliche Schwankungen und beeinflusst die Ionenzusammensetzung solcher Schwarzwasser-Biotope.
1.2. Huminstoffe
Huminstoffe sind organische Biogeopolymere, die sich vor allem aus Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff zusammensetzen (siehe Tabelle 2). Sie entstehen durch den mikrobiellen Abbau pflanzlicher Biomasse. Besonders die für Tiere schwer bis gar nicht zu verdauenden Zellwandbestandteile und Struktur-gebenden Komponenten wie Cellulose und Lignin bilden das Grundgerüst der Huminstoffe. Cellulose ist ein Polysaccharid (Vielfachzucker), das sich aus Glucose-Molekülen hin zu einem großen Makromolekül zusammensetzt. Sogenannte Fibrillen (Fasern) aus Cellulose kommen in den Zellwänden von Pflanzen vor und dienen dort als stabilisierendes und formgebendes Skelett der Zelle. Im Zuge der Verholzung lagern sich Lignine in die Zellwände ein. Lignin (lat. lignum, Holz) setzt sich aus Phenolen – aromatischen Kohlenwasserstoffen – zusammen. In der Zellwand werden die Lignin-Moleküle durch spezielle Enzyme in chemisch hochreaktive Radikale überführt. In einer Kettenreaktion polymerisieren die einzelnen Lignin-Moleküle, sodass die Ligninmasse eines Baumstammes quasi einem einzigen tonnenschwerem Biopolymer gleicht. Durch die nicht-enzymatische, sondern chemisch-radikalische Polymerisation während der Lignifizierung entstehen diverse Lignin-Verbindungen. Auch hierin liegt die strukturelle Diversität der Huminstoffe, die sich besonders auch aus Lignin zusammensetzen, begründet. Der mikrobielle Abbau dieser Holzfasern durch Bakterien und Pilze ist unter anderem auch deshalb so schwer, weil es keine einheitlichen Monomere (Grundbausteine) der Lignin-Polymere gibt und daher verschiedene Enzyme notwendig sind, um diese Lignin-Polymere zu zersetzen. Weitere Polyphenol-reiche Pflanzenstoffe wie Tannine, die als Gerbstoffe in Pflanzen vor phytopathogenen (pflanzenschädlichen) Mikroben schützen, dienen ebenfalls als Grundbausteine für Huminstoffe. Auch durch das Klima, die vorhandene Vegetation, sonstige Bodenbeschaffenheit und die vorhandenen Mikroorganismen und deren Werkzeuge unterscheiden sich die Ausgangspunkte des Humifizierungsprozesses und somit auch dessen Endprodukte. Bei Huminstoffen handelt es sich also um eine enorm heterogene Stoffgruppe. Es gibt keine einheitliche Strukturformel oder Molekülmasse. Huminstoffe variieren in ihrer Größe von 0,1 bis hin zu mehreren Zehntausend Kilodalton (kDa). Als Vergleich; ein Wassermolekül hat eine Größe von 0,018 kDa. Auch in ihrer Struktur variieren Huminstoffe stark. Es ist davon auszugehen, dass jedes Molekül hochmolekularer Huminstoffe quasi einzigartig ist.
Während der sogenannten Humifizierung führt der Abbau pflanzlicher Biomasse, darunter vor allem Lignin und Cellulose aber auch Aminosäuren, Kohlenhydrate und andere Biomoleküle, zur Bildung von Huminstoffen. Sie stellen eine erste Vorstufe der Braunkohle dar. In einer nachfolgenden geochemischen Phase der Inkohlung kommt es unter hohen Temperaturen und Drücken zur chemischen Bildung von Kohle.
| Element | Massenanteil[%] |
|---|---|
| Kohlenstoff | 40 - 60 |
| Wasserstoff | 4 - 6 |
| Sauerstoff | 30 - 40 |
| Stickstoff | 1 - 6 |
| Schwefel | <2 |
| Phosphor | 0,005 |
| Metalle | 0,000001 - 2 |
Huminstoffe werden hinsichtlich ihrer Extraktionseigenschaften in drei verschiedene Gruppen unterteilt. Die gelb- bis gelbbraunen und wasserlöslichen Fulvinsäuren reagieren besonders sauer. Sie sind 2000 bis 9000 Dalton (Da) groß und bestehen weniger aus aromatischen Gruppen wie Phenolen, sondern bestehen aus bis zu 30% aus Polysacchariden. Sie sind in kalter Natronlauge und kaltem Wasser löslich. Huminsäuren hingegen sind nicht in Wasser, jedoch in kalter Natronlauge löslich. Sie bestehen vor allem aus aromatischen Polyphenolen und sind teilweise mehr als 100000 Da groß. Phenolgruppen reagieren nur schwach sauer. Daher dissoziieren Huminsäuren nicht in Wasser, sondern werden nur in Anwesenheit eines starken Protonenakzeptors (Base) wie Natronlauge deprotoniert. Die Salze der Huminsäure heißen Humate und kommen zum Beispiel in der Tierfuttermittelindustrie zum Einsatz. Humine weisen einen hohen Polymeriationsgrad auf und sind weder in Wasser noch in kalter Natronlauge löslich.
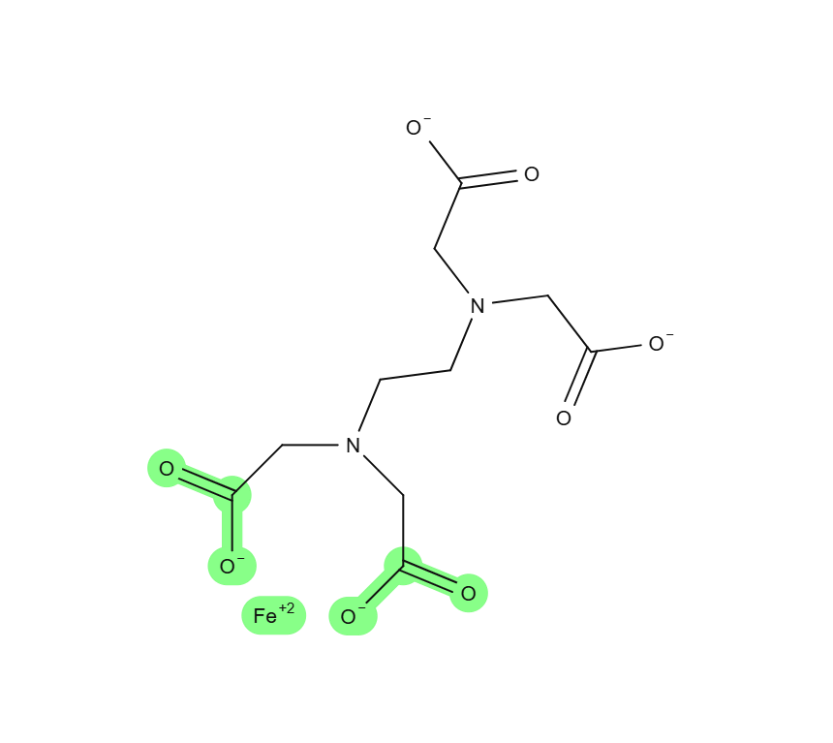
Es gibt verschiedene chemische funktionelle Gruppen, die in Huminstoffen vertreten sein können und zu verschiedensten Eigenschaften der Huminstoffe führen. Für den Säure-Charakter der Huminstoffe sind vor allem Carbonsäuren (-COOH) verantwortlich. Die genaue Säurestärke hängt stark von den benachbarten Atomen ab. Daher säuern Huminstoffe je nach Struktur unterschiedlich stark das Wasser an. Huminstoffe sind jedoch insgesamt schwache Säuren, da sie deutlich schwächer als starke Säuren, wie beispielsweise Salzsäure, Salpetersäure oder Schwefelsäure, wirken. Als schwache Säuren bilden sie ähnlich wie Carbonate ein pH-Puffersystem, das jedoch bei deutlich niedrigeren pH-Werten puffert. Die durch die Abgabe der sauer wirkenden Protonen deprotonierten Salze der Huminstoffe können wieder bei entsprechenden pH-Stürzen unterhalb des Pufferbereichs wieder Protonen aufnehmen. In ihrer deprotonierten Form liegen Carbonsäuren als Carboxylate vor. Mehrere solcher Carboxylat-Gruppen, die in räumlicher Nähe zueinanderstehen, und eine Scheren- Struktur ausbilden, können als sogenannte Chelatoren (griech. chele, Krebsschere) Metallionen komplexieren. Huminstoffe sind in der Bodenkunde als wichtige Eisen-Chelatoren bekannt, die bei sauren pH-Werten < 5 dreiwertige Eisenoxide zu Fe2+, das von Pflanzen aufgenommen wird, reduzieren und binden können (Zanin et al. 2019). In der Natur übernehmen Huminstoffe vielerorts in Böden und Gewässern ähnliche Aufgaben wie synthetische Chelatbildner, beispielsweise Ethylendiamintetraacetat (EDTA). Huminstoffe besitzen jedoch weitere Sauerstoff- und Stickstoff-haltige funktionelle Gruppen, die koordinative Bindungen ausbilden und somit zur Bildung von Humin-Metall-Komplexen führen können. Neben zweiwertigen Eisen-Ionen können diese Chelat-Untereinheiten von Huminstoffe auch andere divalente Kationen wie zum Beispiel das Erdalkalimetallion Ca2+ binden. Auch monovalente Kationen wie Kaliumionen (K+) können je nach Struktur gebunden werden. Ähnlich wie ein Kationenaustauscherharz können Huminstoffe Sulfonsäuregruppen enthalten, die sauer wirkende Protonen gegen Kalium, Natrium oder Ammonium austauschen können. Huminstoffe entziehen dem Wasser zudem Schwermetalle wie Blei oder Kupfer und bilden mit diesen Metallen oft unlösliche Humin-Metall-Komplexe.
Huminstoffe fungieren nicht nur als pH-Puffer, sondern auch als Redoxpuffer, da sie ein amphoteres Redoxverhalten aufweisen. Die aromatischen Polyphenol- und Chinongruppen der Huminstoffe können Sauerstoffradikale neutralisieren, sodass Huminstoffe als Antioxidantien wirken. Gleichzeitig enthalten Huminstoffe oftmals selbst stabile Radikale, sodass sie auch als Oxidantien wirken können. Die Rolle reaktiver Sauerstoffspezies und stabiler Radikale in Huminstoffe als positiver Stress werden in Kapitel 2.2.1. näher behandelt. Die Interaktion von Huminstoffen und Organismen wurde bereits in vergangenen Jahren untersucht, wie zum Beispiel der Einfluss von Huminstoffen auf die Osmoregulation aquatischer Organismen (siehe Kapitel 2.4.)
1.3. Geografische Verteilung von Schwarzwasser-Biotopen
Klassische Schwarzwasser-Biotope sind primär in den Tropen zu verzeichnen, da die hier andauernden hohen Temperaturen rund um den Äquator und dem feuchten Klima zu einer hohen Vegetationsdichte führen. Verglichen mit anderen Schwarzwasser-Biotopen wurden die Schwarzwasser-Biotope Südamerikas in den vergangenen 100 Jahren besonders gut studiert. Dennoch gibt es auch außerhalb Südamerikas Schwarzwasser-Biotope mit beeindruckenden Fischgemeinschaften. In Zentralafrika, zum Beispiel dem Kongo-Becken, leben Killifischarten der Gattungen Aphyosemion und Fundulopanchax sowie Zwergbuntbarsche der Gattungen Nanochromis und Pelvicachromis in dunkelbraun gefärbten Gewässern, die stellenweise Torf als Untergrund haben jedoch nicht so stark sauer sind wie manche Schwarzwasserbiotope Südamerikas. In den Schwarzwasser-Lagunen des Kakadu National Park, Cape York Australien, sind Regenbogenfische der Gattungen Melanotaenia und Pseudomugil vertreten. Die beiden südostasiatischen Inseln Borneo und Sumatra zeichnen sich nicht nur durch ihr tropisches Klima, sondern auch ihre Biodiversität aus. Auf beiden Inseln finden sich Schwarzwasser- führende Regenwaldbäche in denen Laubkampffische wie Betta brownorum oder Betta coccina gefunden wurden. Die Lebensräume solcher Laubkampffische und anderer Schwarzwasserbewohner sind jedoch gefährdet. Besonders in Indonesien werde viele Torfmoore trockengelegt und Wälder gerodet, um dort Palmölplantagen anzulegen.

Schwarzwasser-Biotope sind jedoch nicht nur auf die Tropen begrenzt. Im Okefenokee National Wildlife Refuge – ein nationales Schutzgebiet für Wildtiere im Südosten der USA an der Grenze der beiden US-Bundestaaten Georgia und Florida – befindet sich mit dem Okefenokee-Sumpf das größte Schwarzwasser-System Nordamerikas. Hier kommen bei feuchtem subtropischem Klima Sonnenbarsche, Knochenhechte und Zwergschwarzbarsche wie Elassoma okefenokee vor. Auch in Europa finden sich Schwarzwasser-Biotope, vor allem in Torfmooren. Die Artenvielfalt nimmt mit zunehmender Distanz zum Äquator und den Tropen jedoch drastisch ab, was jedoch ein allgemeines Muster der Biodiversität darstellt und als „Breitengradient der Artenvielfalt“ bekannt ist.
1.4. Südamerikanische Schwarzwasser-Biotope als Biodiversitäts-Hotspots
Das Amazonasbecken ist mit 6.869.000 km2 das größte hydrografische Süßwassersystem der Welt und beherbergt die artenreichste Fischfauna (Ichthyofauna) im Süßwasser (Goulding et al. 2003, Reis et al. 2016). Die Fischgemeinschaften aus Schwarzwasser-Biotopen sind dabei mindestens genauso artenreich und zum Teil sogar noch artenreicher als die Biodiversität der Ichthyofauna in Weißwasser-Biotopen (Saint-Paul et al. 2000). In Schwarzwasser-Biotopen wurden bis zu 172 verschiedene Arten gefunden, in Weißwasser-Biotopen bis zu 148 (siehe Abbildung 5). Die Artenvielfalt in Schwarzwasser-Biotopen wird dabei nicht nur von in diesen Gewässern selten vorkommenden Arten bestimmt. Auch die beobachtete Anzahl der Arten, die 75% der Biomasse in diesen Biotopen ausmachen, war im Schwarzwasser höher als im Weißwasser (Saint-Paul et al. 2000). Aufgrund der geringen Ionenverfügbarkeit im Schwarzwasser und dem hohem Nährstoffgehalt im Weißwasser, findet sich im Schwarzwasser weniger Biomasse in Form von Fischen verglichen zu Weißwasser-Biotopen (Saint-Paul et al. 2000).
2. Grundlagen der Fischphysiologie
Aus tierphysiologischer Sicht stellt sich die berechtigte Frage wie Fische und andere aquatische Organismen in derart sauren und ionenarmen Gewässern überhaupt überleben können. Um dieser Frage nachzugehen sind zunächst einige Grundlagen zu Ökologie, Evolution und Fischphysiologie notwendig, die in den nachfolgenden Kapiteln besprochen werden.
2.1. Physiologische und ökologische Potenz
Häufig wird behauptet, dass Organismen perfekt an ihre natürlichen Lebensräume angepasst sind und deshalb genau dort vorkommen. So wird sowohl das Vorkommen endemischer Arten, als auch Arten mit breitem Verbreitungsgebiet versucht zu erklären. Doch anhand welcher Faktoren wird das Verbreitungsgebiet einer Spezies festgelegt? Hierzu müssen die verschiedenen Parameter betrachtet werden, die in einem Ökosystem wichtig sind. Diese Parameter lassen sich einteilen in abiotische Faktoren, die alle physikochemischen Parameter berücksichtigen (Temperatur, pH, Salinität, Sauerstoff etc.) und biotische Faktoren, die andere Organismen in eben jenem Ökosystem erfassen (Nahrungsangebot, Räuber, Konkurrenten etc.).
Die physiologische Potenz einer Art legt fest in welchen Bereichen abiotischer Faktoren eine Art überleben kann. Bspw. kann eine Art bei pH 3 – 10 überleben, wobei jedoch häufig ein physiologisches Optimum zu beobachten ist, bei dem die Überlebensrate in Abhängigkeit eines bestimmten abiotischen Faktors am höchsten ist. Nicht alle Arten bilden ein spezifisches Optimum in Form eines Maximus aus. Eurypotente (euryök, griech eurys = breit) Arten besitzen eine breite physiologische Potenz mit teilweise breitem Optimum. Stenopotente (stenök, griech stenos = eng) Arten hingegen besitzen eine weniger große physiologische Potenz und häufig ein eher punktuelles physiologisches Optimum.
Die physiologische Potenz gibt eine grundlegende Spannweite eines Umweltparameters an, in der eine Art überleben kann. Ein weiterer wichtiger Faktor ist die ökologische Potenz, da diese die biotischen Faktoren berücksichtigt. Hierzu zählt beispielsweise die Konkurrenzstärke. Nach dem biologischen Konkurrenz-Ausschluss-Prinzip können zwei Arten, die exakt dieselben begrenzten Ressourcen benötigen, langfristig nicht koexistieren können. In der Natur haben Arten mit beispielsweise höherer Reproduktionsrate oder breiterem Nahrungsangebot einen Vorteil gegenüber anderen Arten. Gemeinsam bilden die physiologische und die ökologische Potenz den Existenzbereich einer Art, auch ökologische Nische genannt. Besitzen zwei Arten dieselbe physiologische Potenz, aber unterschiedlich starke ökologische Potenzen, so kann die Art mit der höheren ökologischen Potenz näher an ihrem physiologischen Optimum leben und das Existenzoptimum gleicht quasi dem physiologischen Optimum (siehe Abbildung 6 A). Arten mit ähnlicher physiologischer Potenz und geringerer ökologischer Potenz werden aus der ökologischen Nische, in der das physiologische Optimum vorherrscht, verdrängt. Ihr Existenzoptimum verschiebt sich und gleicht nicht mehr dem physiologischen Optimum (siehe Abbildung 6 B).
Es ist nicht immer die Konkurrenzstärke, die das Vorkommen einer Art einschränken. Auch das Nahrungsangebot, geografische Trennung oder andere ungünstige abiotische Umweltfaktoren können die Besiedlung des physiologischen Optimums, das für jeden Parameter einzeln bestimmt wird, verhindern. Stellen die Heimatgewässer unserer Fische immer das physiologische Optimum eines jeden physikochemischen Parameters dar, die man nachahmen sollte? Diese Frage können wir als Aquarianer nicht beantworten. Hier ist die Experimentierfreudigkeit und der Erfahrungsaustausch der Aquarianerschaft gefragt.

2.1.1. Wann "fühlen" sich Fische "wohl"?
Der Begriff des „Wohlfühlens“ wird unter Tierhaltern gerne verwendet, auch in der Aquaristik. Aus biologischer Sicht ist der Begriff jedoch schwer zu definieren. Das Wohlfühlen eines Fisches lässt sich nicht messen. Hierbei handelt es sich oft um subjektives Empfinden des Fischhalters. Die Vitalität eines Fisches hingegen lässt sich quantifizieren und beschreiben, besonders durch arttypisches Verhalten, gesunden Appetit, allgemeine Gesundheit, Atemfrequenz sowie Fortpflanzung. Man spricht vom Zustand der sogenannten Homöostase, ein Prinzip durch das der Körper ein inneres Gleichgewicht seiner physiologischen Funktionen aufrechterhält. Inwiefern sich ein Fisch darüber hinaus wohlfühlen kann, lässt sich nicht sagen. Die Suche nach dem perfekten Haltungs-Optimum wird daher nie beendet sein. Zumindest nicht mit unserem aktuellen Wissensstand und den uns zur Verfügung stehenden Messtechniken.
2.1.2. Mythos Arterhaltungstrieb
Ein weitverbreiteter Mythos in der Aquaristik ist der sogenannte „Arterhaltungstrieb“, mit dem die Fortpflanzung als Anzeichen für Vitalität widerlegt werden soll. Jedoch wurde bereits im vergangenen Jahrhundert das Konzept des Arterhaltungstriebs in der Biologie für widerlegt erklärt. Der britische Zoologe und Evolutionsbiologe Richard Dawkins publizierte 1976 die Erstausgabe seines populärwissenschaftlichen Buches „Das egoistische Gen (Englischer Originaltitel „The selfish gene“), indem er die Frage diskutierte was die kleinste Einheit in der Biologie ist, auf die die natürliche Selektion wirkt. Sind es Ökosysteme? Organsimengruppen? Einzelne Individuen? Oder doch die Art? Dawkins postulierte, dass es die egoistischen Gene sind, die infolge der der natürlichen Selektion „überleben“ oder nicht „überleben“ (Dawkins, 2014). Gene sind die Replikatoren der Evolution, die sich versuchen zu erhalten. Hierzu benötigen Gene jedoch sogenannte Vehikel (meist Organismen), um ihren Fortbestand zu sichern.
Dass es keinen Trieb zur Arterhaltung geben kann, wird bereits aus der Tatsache deutlich, dass die intraspezifische Konkurrenz, also die Konkurrenz um dieselben Ressourcen innerhalb einer Art, am höchsten ist. Nicht selten endet der Konkurrenzkampf zwischen Individuen derselben Art um Ressourcen wie Nahrung, Platz und Fortpflanzungspartner tödlich, egal ob Käfer, Fisch, Seeelefant oder Mensch. Nach Darwins Evolutionstheorie (siehe Kapitel 2.3.) überlebt nur das fitteste Individuum, nicht eine ganze Art.
Ein demonstratives Beispiel zeigt sich in der Mikrobiologie. Durch bakterielle Konjugation können manche Bakterien, die als asexuell gelten, Erbmaterial an andere Individuen weitergeben, auch an artfremde. Bakterien wie Acinetobacter baumannii besitzen zirkuläre DNA-Moleküle, sogenannte Plasmide, zusätzlich zu ihrer chromosomalen DNA. A. baumannii kann diese Plasmide durch das Ausbilden sogenannter Sex-Pili weitergeben. Auf diesen Plasmiden sind häufig neben praktischen Antibiotikaresistenzen auch die Gene codiert, die für diese Weitergabe notwendig sind und sich somit selbst erhalten. Einen Vorteil hat A. baumannii dadurch nicht. Eher im Gegenteil, praktische Antibiotikaresistenzen, die einem Bakterium einen Vorteil im Ökosystem verschaffen, werden an andere Arten weitergegeben. Da Bakterien wie A. baumannii keine kognitiven Fähigkeiten besitzen und beispielsweise nicht konditioniert werden können, fällt das Prinzip des reziproken Altruismus, also die Erwartungshaltung, dass ein begünstigendes Verhalten nicht-verwandter Individuen zu einem späteren Zeitpunkt zu einer Belohnung führt, weg.
Aquarianer müssen sich also nicht ohne Grund mit der erfolgreichen Pflege ihrer Fische auseinandersetzen und dies durch zum Teil hohen Aufwand bewerkstelligen, um erfolgreich Fische nachziehen zu können.
2.2. Stressbegriff in der Biologie
Als Stress wird in der Biologie eine Umweltbedingung bezeichnet, die einen Organismus zu einer direkten physiologischen Anpassungsreaktion zwingt. Die Auslöser, die auch als Stressoren bezeichnet werden, können unterschiedlicher Natur sein. Ein wohl allen bekanntes Beispiel ist der Hitzestress durch zu hohe Temperaturen. Dieser Hitzestress führt schlimmstenfalls zu lebensbedrohlichen Herz-Kreislauf-Problemen. Eine Anpassungsreaktion des menschlichen Körpers zur Aufrechterhaltung der Körpertemperatur bei Hitze stellt das Schwitzen dar. Akute Stressreaktionen führen zu einer abweichenden Stoffwechselaktivität, die Energie für zusätzliche Prozesse erfordert, die während des Grundumsatzes (Basalstoffwechsel) nicht erforderlich sind.
Das zentrale und periphere Nervensystem spielt eine entscheidende Rolle in der Stressreaktion. Durch entsprechende Rezeptoren werden verschiedene Arten Stressoren wahrgenommen, wie beispielsweise osmotischer Stress, Hitzestress, Photostress durch Lichtveränderungen oder mechanische Stressoren durch das Annähern eines Raubfisches, wahrgenommen durch das Seitenlinienorgan. Diese Sinneswahrnehmung findet sowohl durch normale Rezeptoren, als auch durch spezielle Schmerz-Rezeptoren (Nozizeptoren), die auf potentiell schädliche Reize reagieren. Nozizeptoren sind, ähnlich wie die normalen sensorischen Rezeptoren, auf bestimmte Umweltfaktoren spezialisiert und überall im Körper verteilt. Das zweite wichtige Steuer- und Kommunikationssystem im Tierkörper stellt das Hormonsystem dar. Hormone sind Botenstoffe, die neben dem Nervensystem der Kommunikation zwischen Geweben und Zellen dienen. Es existieren verschiedene Hormonklassen, die sich nach chemischer Struktur oder Zielwirkung einteilen lassen. Eine wichtige Gruppe von Hormonen während der Einwirkung von Stressoren sind Stresshormone wie Cortisol, Adrenalin oder Noradrenalin. Sie werden in der Nebenniere freigesetzt. Die Nebenniere ist bei Säugetieren eine paarige Hormondrüse am oberen Pol der Nieren. Sie gliedert sich in zwei verschiedene Gewebe; dem Nebennierenmark und der Nebennierenrinde, die das Mark umgibt. In Fischen unterteilt sich die Nebenniere in zwei voneinander getrennten Organen; dem Interrenalorgan (vergleichbar mit der Nebennierenrinde) und dem Adrenalorgan (vergleichbar mit dem Nebennierenmark). Die chromaffinen Zellen des Adrenalorgans produzieren und sezernieren die Stresshormone Adrenalin und Noradrenalin (sogenannte Katecholamine). Sie bilden die primäre Stressantwort, da sie rasch ausgeschüttet werden und bei akutem Stress als erstes ausgeschüttet werden. Sie führen unter anderem zu einer erhöhten Herzfrequenz sowie einem erhöhten Bluthochdruck. Währenddessen schütten die interrenalen Zellen des Interrenalorgans Sexualhormone, Mineralcorticoide und Glucocorticoide aus, die sich aus dem Vorläufermolekül Cholesterin herleiten. Mineralcorticoide wie Aldosteron regulieren die Nieren und damit den Ionenhaushalt des Fischkörpers. Glucocorticoide besitzen vielfältige Aufgaben, darunter die Regulation des Kohlenhydratstoffwechsels, Mobilisierung von Aminosäuren und die Regulation antiinflammatorischer (entzündungshemmender) Prozesse. Zu den Glucocorticoiden zählt beispielsweise das Steroidhormon Cortisol. Die Hormon-Ausschüttung des Interrenalorgans besitzt im Gegensatz zum Adrenalorgan eine langsamere Reaktion, hält jedoch länger an und klingt langsam ab.
Stressoren wirken auf verschiedene Zelltypen innerhalb eines Gewebes, sowohl auf entsprechende Gewebezellen als auch Rezeptoren oder Schmerzrezeptoren (Nozizeptoren) des neuronalen Systems (siehe Abbildung 9). Afferente Bahnen des Nervensystems leiten die Stress-Information an das Gehirn weiter, wo die Informationen vom Zwischenhirnboden (Hypothalamus) verarbeitet werden. Der Hypothalamus innerviert (steuert) über efferente Bahnen direkt das Adrenalorgan innerhalb weniger Sekunden, weshalb Katecholamine wie Adrenalin und Noradrenalin die akute Stressantwort auslösen. Gleichzeitig schüttet der Hypothalamus das cortitrophes-Releasing-Hormon (CRH) aus, das auf die Hirnanhangsdrüse (Adenohyphose) wirkt. Hier wird das adrenocortitrophe Hormon (ACTH) ausgeschüttet, das als Ziel- und Wirkort die Zellen des Nebennierenrinde-artigen Interrenalorgans hat. In der hormonell gesteuerten Aktivierung des Interrenalorgans, im Gegensatz zum neuronal gesteuerten Adrenalorgan, ist auch dessen langsamere aber nachhaltiger wirkende Reaktion begründet.
Stressoren wirken jedoch nicht nur auf neuronale Zellen, sondern auch direkt auf spezifische Gewebezellen. Hierzu dienen oft Rezeptoren für unterschiedliche (meist abiotische) Stressoren. Das Stresssignal löst eine Signalkaskade innerhalb der Zelle aus, wodurch spezielle Hormon-Rezeptoren gebildet werden, die eine weitere Steuerung durch Hormone wie Katecholamine oder Glucocorticoide zulassen, indem sie jene binden und daraufhin eine Stressantwort auf molekularer Ebene innerhalb der Zellen auslösen. Je nach Lokalität der Stressreaktion können die über die Blutbahn freigesetzten Hormone so gezielt an die Zelltypen andocken, die auch entsprechende Rezeptoren auf ihrer Oberfläche tragen.
2.2.1. Huminstoffe als Eustress?
Neben akutem und chronischem Stress wird in der Biologie teilweise auch zwischen Distress und Eustress unterschieden. Distress ist negativer Stress, der chronisch zu einer Dysregulation körperlicher Funktionen führen kann, wie etwa Immunsuppression. Eustress hingegen beschreibt Anpassungsreaktionen, die sich noch im Bereich des physiologischen Gleichgewichts befinden und zu einem Vorteil durch eine allgemein erhöhte Widerstandsfähigkeit führen. Diese Unterteilung zwischen Distress und Eustress ist in der Wissenschaft nicht unumstritten. So wurde beispielsweise im Jahre 2020 im Fachjournal BioEssays ein Aufsatz publiziert, mit dem Titel „Eustress und Distress; Weder gut noch schlecht, sondern eher dasselbe?“ (Bienertova‐Vasku & Scheringer 2020). In dem Aufsatz wird unter anderem bemängelt, dass es (Stand 2020) 16400 Publikationen mit dem Schlagwort „Distress“, aber nur 203 Publikationen mit dem Schlagwort „Eustress“ zu finden gibt. Während Naturwissenschaftler also eine recht gute Vorstellung davon haben was schädlicher Distress ist, ist das abstrakte Konzept des positiven Eustress bislang eher dürftig definiert. Abseits des wissenschaftlichen Disputs über Begrifflichkeiten und Definitionen, existieren dennoch interessante Zusammenhängen zwischen Stressoren und sich daraus ergebenden Vorteilen.
Auch Huminstoffen wird eine Wirkung als positiver Stressor nachgesagt. Huminstoffe besitzen stabile Radikale. Radikale sind Teilchen mit einem ungepaarten Elektronenpaar, also einem freien Elektron auf der Suche nach einem „Partner-Elektron“, weshalb sie sehr reaktiv sind. Reaktive Sauerstoffspezies werden beispielsweise maßgeblich mit für den Alterungsprozess (Seneszenz) verantwortlich gemacht. Reaktive Sauerstoffspezies entstehen unter anderem durch einen fehlerhaften oder unvollständigen Ablauf der durch die O2-Oxidoreduktase katalysierten Reduktion von Sauerstoff zu Wasser. Die entstehenden Sauerstoffradikale, wie beispielsweise Superoxid-Anionen oder Hydroxylradikale, greifen Zellstrukturen an was zum Verschleiß der molekularen Zellstrukturen und letztendlich zur Alterung des Organismus führt. Proteinoxidationen sorgen für Fragmentierung stabilisierender oder katalytisch aktiver Proteine, Lipidoxidationen verändern Membranpotentiale und die Fluidität von Membranen und Schäden des Erbguts sind ebenfalls eine Folge dieser reaktiven Sauerstoffradikale. Zellen besitzen jedoch Reparaturmechanismen. Damit Proteine nicht denaturiert bzw. entfaltet werden, indem tertiäre Strukturen zwischen hydrophoben und hydrophilen Aminosäuren werden gestört werden und zur Aggregation mit anderen Proteinen führen kann, gibt es sogenannte Hitzeschockproteine. Der Name verrät schon woher man die Proteine kennt; bei Temperaturanstiegen werden Proteine denaturiert, indem ihre tertiäre Faltstruktur gestört wird. Die quartären Strukturen bilden sich vor allem durch Wasserstoff-Brücken-Bindungen aus. Führt man diesen schwachen Bindungen Energie zu, lösen sie sich. Hitzeschockproteine stabilisieren entfaltete Proteine und falten sie teilweise wieder neu, indem sie hydrophobe und hydrophile Milieus "nachahmen", wodurch die korrekte Faltung angetrieben wird.
Huminstoffe mit oxidativem Potential fördern genau diese Protein-Denaturierung. Der Organismus nimmt den oxidativen Stress wahr und synthetisiert mehr Hitzeschockproteine (HSP), um Proteine vor oxidativen Schäden zu schützen. Diese vermehrte Expression von hsp-Genen wurde unter anderem in dem Fadenwurm Caenorhabditis elegans beobachtet (Menzel et al. 2005). In Tierversuchen mit dem C. elegans, Wasserflöhen der Gattung Daphnia und Schwertträgern (Xiphophorus helleri) wurde daher die Wirkweise von Huminstoffen als lebensverlängernder Eustressor untersucht. Der Nematode C. elegans suchte bei Versuchen auf Agarplatten regelrecht nach Huminstoff-reichen Zonen, wenn gewisse Regionen einer Agarplatte mit einem synthetischen Huminstoff oder natürlicher organischer Masse an Huminstoffen angereichert wurden (Menzel et al. 2005). Zusätzlich wurde beobachtet, dass sowohl die Exposition der synthetischen als auch natürlich isolierten Huminstoffe zu einer vermehrten Expression von Genen führte, die für Hitzeschockproteine codieren. Während für ein synthetisches Huminstoffpräparat eine signifikante lebensverlängernde Wirkung von einigen Tagen auf C. elegans festgestellt wurde, blieb eine solche Beobachtung für natürliche organische Masse (Huminstoffe), die aus einem Brandenburger See mit hohem Anteil an gelösten organischen Kohlenstoff isoliert wurde, aus (Steinberg et al. 2007). Diese Ergebnisse zeigen, dass aufgrund der Heterogenität der Huminstoffe keine allgemeingültigen Aussagen über Huminstoffe hinsichtlich ihrer Bioaktivität getroffen werden können. Die Versuche wurden zusätzlich mit gemeinen Wasserflöhen (Daphnia magna) durchgeführt. Daphnia magna vermehrt sich unter stressfreien Bedingungen asexuell durch Parthenogenese (Jungfernzeugung), sodass lediglich weibliche Klone mit denselben genetischen Anlagen gebildet werden. Unter Einfluss von Stressoren kommt es zur Bildung von männlichen Nachkommen und der sexuellen Reproduktion, um befruchtete Dauereier zu bilden, die bei besseren Umweltbedingungen erneut schlüpfen. Die Zugabe von Huminstoffen (synthetisch & aus der Natur isoliert) führte zur Bildung von männlichen Nachkommen. Darüber hinaus konnte eine geschlechterspezifische Lebenszeitmodulation beobachtet werden (Euent et al. 2008). Während die Lebensspanne weiblicher D. magna bei Konzentrationen synthetischer Huminstoffe von 2,15 bis 10,75 mg/L einen negativen Effekt auf die Lebensspanne hatten, konnte für die männlichen D. magna gezeigt werden, dass 10,75 mg/L und insbesondere die niedrigere Konzentration von 2,75 mg/L eine signifikante Verlängerung der Lebensspanne um bis zu 10 Tage nach sich zog. Untersuchungen mit Schwertträgern (Xiphophorus helleri) zeigten die Bildung einer multiplen Stressresistenz (Meinelt et al. 2004). Junge Schwertträger wurden 9 Wochen nach ihrer Geburt zwei Wochen lang täglich mit Keschern gefangen und in neues Wasser überführt. Während dieser zwei Wochen nahm die Gewichtszunahme vollkommen ab und stagnierte. Die Gewichtszunahme wurde anschließend weiter bis zur 21. Lebenswoche dokumentiert. Die Kontrollgruppe ohne Zugabe von Huminstoffen zeigte auch in den anschließenden zehn Wochen eine Stagnation der Gewichtszunahme. Die Exposition von 5; 30 oder 180 mg/L eines synthetischen Huminstoffes führte hingegen dazu, dass die Tiere nach der zweiwöchigen Stress-Prozedur in gleichem Tempo Gewicht zunahmen und auch vor der Stress-Behandlung besser und schneller wuchsen als die Kontrollgruppen. Huminstoffe führten als Stressor zu einer multiplen Stressresistenz, indem auch der mechanische Stress des Herausfangens und Umsetzens besser bewerkstelligt wurde, wenn Huminstoffe als Stressor anwesend waren. Diese multiple Stressresistenz ist auf molekularbiologischer Ebene wahrscheinlich unter anderem darauf zurückzuführen, dass die vermehrte Produktion von Hitzeschockproteinen auch in anderen Stresssituationen wie thermischem Stress eine erhöhte Widerstandsfähigkeit sichert. Derzeit steht noch die Frage aus, ob diese Stressresistenz epigenetisch auch an die Nachkommen weitergegeben werden kann (siehe Kapitel 2.3.). Eine Korrelation zwischen eingesetzter Dosis und Wirkgrad konnte dabei nicht festgestellt werden. Dass zu hohe Expositionen von Huminstoffen jedoch einen toxischen Effekt auf Fische haben können, wurde für Embryonen des Zebrabärblings (Danio rerio) aufgezeigt, dessen Überlebensrate bei einer Huminstoffkonzentration von 500 mg/L beinahe bei 0% liegt.
Der Einfluss von Huminstoffen auf Tiere folgt einer hermetischen Wirkkurve (siehe Abbildung 11). In niedrigeren Konzentrationen sorgen Huminstoffe für einen positiven Effekt auf den Organismus, indem sie die allgemeine Widerstandsfähigkeit des Organismus erhöhen. Eine weitere Erhöhung der Konzentration führt jedoch ab einem gewissen Zeitpunkt zu einer umgekehrten Wirkung. Bei zu hoher Dosis wirken Huminstoffe schädlich und verringern die Widerstandsfähigkeit. Insbesondere Organismen, welche aus Schwarzwasser-Habitaten stammen, haben jedoch auch mit hohen Huminstoffkonzentrationen keine Probleme. Inwiefern Arten aus Karstgewässern mit hohen Huminstoffkonzentrationen, wie sie im Schwarzwasser vorzufinden sind, zurechtkommen, ist noch nicht untersucht. Wahrscheinlich gilt auch hier das altbekannte Prinzip von Paracelsus „Die Dosis macht das Gift“.
Die genaue Aufnahme von Huminstoffen von Fischen und anderen aquatischen Organismen ist bisher noch nicht genau bekannt. Neben der oralen Aufnahme über das Futter ist auch eine Aufnahme über die Kiemen oder die Haut denkbar, zumindest für kleinere Huminstoffe, die nicht größer sind als 500 Da. Trotz der vielen aromatischen und damit lipophilen Strukturen der Huminstoffe ist es fraglich, ob sie aufgrund der vielen deprotonierten und somit lipohoben Carboxyl- und Hydroxygruppen durch die lipophile Zellmembran passiv diffundieren können. Zwar gibt es einzelne Studien, in denen radioaktiv markierte Huminstoffe intrazellulär nachgewiesen werden konnten, jedoch äußern Kritiker, dass es sich hierbei um synthetische Huminstoffe handelt, sodass kein direkter Vergleich zu nativen Huminstoffen gezogen werden kann und keine quantitative Einschätzung der Huminstoff-Aufnahme möglich ist (Kulikova et al. 2010). Kleinere Huminstoffen könnten durch unspezifische Transporter-Proteine in der Zellmembran aufgenommen werden oder gelangen durch parazelluläre Wege durch die Zwischenräume der Epithelzellen (Tight Junctions) in das Gewebe. Eine Adsorption an die Zelloberfläche hingegen ist möglich und führt möglicherweise zur Aktivierung von Signaltransduktionswegen innerhalb der Zellen. Dass eine Adsorption (=“Anheftung“) von Huminstoffen an Zellmembranen deren Permeabilität (=Durchlässigkeit) erhöhen kann, wurde bereits für Phytoplankton gezeigt (Vigneault et al. 2000). Auch die direkte Aufnahme kleinerer Abbauprodukte (z.B. freigesetzt von Bakterien) von Huminstoffen sind nicht auszuschließen und wurde bereits in der Wissenschaft diskutiert. Während die biologische Aktivität von Huminstoffen unbestritten ist, herrscht über die genauen Wirk- und Aufnahmemechanismen noch Unstimmigkeit.
2.3. Anpassung, Adaptation & Evolution
Stress als der Auslöser für Anpassungsreaktionen treibt maßgeblich die Evolution an. In der Biologie spricht man nicht nur im Rahmen der Evolution von Anpassung. Auch Stressantworten bzw. Akklimatisation auf sich ändernde Umweltfaktoren sind eine direkte physiologische Anpassungsreaktion, bei der die Plastizität der Zellen und Gewebe ausgeschöpft wird. Der Begriff Adaptation beschreibt in einem evolutionsbiologischen Kontext die Anpassung einer Population bzw. Spezies auf genetischer Ebene über mehrere Generationen. Fische haben, wie alle Tiere, einen genetisch festgelegten Umfang für direkte Anpassungsreaktionen bei akutem Stress. Bei langanhaltendem Stress haben Individuen, die durch gewisse Eigenschaften ihres Erbmaterials besser an gewisse Umweltfaktoren angepasst sind als andere Individuen ihrer Art, einen Vorteil Hier gilt das durch Darwin postulierte Prinzip „Survival of the fittest“. Durch natürliche Selektion werden solche Eigenschaften des Erbmaterials innerhalb der Population und/oder Art über mehrere Generationen hinweg gefestigt, sodass sie sich an bestimmte Umweltfaktoren adaptiert.
Eine Zwischenform der individuellen Anpassung und der langfristigen Adaption einer Art stellt die Epigenetik dar. Hierbei wird nicht die Sequenz der DNA verändert, sondern die Aktivität einzelner Gene. Durch die Anlagerung bestimmter funktioneller Gruppen, bspw. Methylgruppen, an das Grundgerüst der DNA kann das Ablesen eines gewissen Bereichs (Gen) des Erbmaterials inaktiviert oder aktiviert werden. Diese Form der DNA-Modifikation ist eine schnelle und reversible Anpassungsreaktion auf Stresssituationen. Zusätzlich können diese epigenetischen Muster auch an Nachkommen vererbt werden, sodass Nachkommen an gewisse Umweltbedingungen automatisch besser angepasst sind, ohne durch Evolution und Mutationen in der DNA-Sequenz adaptiert zu sein.
2.4. Osmoregulation & Exkretion von Knochenfischen aus Schwarzwasser-Biotopen
Wie in Kapitel 1 besprochen enthält Schwarzwasser im Vergleich zu anderen Gewässern sehr wenige Ionen. Besonders die Menge an Calcium- und Magnesium-Ionen ist im Vergleich zu anderen Gewässern sehr gering. Wie können Knochenfische, die Calcium und Magnesium zum Aufbau von Knochengewebe benötigen, so erfolgreich in so extremen Lebensräumen überleben? Die Osmoregulation und Exkretion von Knochenfischen und ihre spezielle Adaptationen an diese extremen Lebensräume werden in diesem Kapitel behandelt.
2.4.1. Osmose als Form der Diffusion
Die Anzahl von Teilchen wie Ionen oder bspw. Blutzucker zwischen dem Blutplasma des Fisches und dem umgebenden Wasser unterscheiden sich zum Teil um das hundert- bis tausendfache. Oft ist von einer treibenden Kraft die Rede, die einzelne Teilchen zwingt eine gleichmäßige Verteilung anzustreben. Eine Membran, die nur bestimmte Teilchen durchlässt (semipermeable Membran) fungiert wie ein Sieb, durch das sich nur sehr kleine Teilchen bewegen (diffundieren) können. Durch biologische Membranen, die aus Fettsäuren bestehen, können Ionen nicht ohne weiteres diffundieren. Ionen besitzen eine sogenannte Hydrathülle. Aufgrund der Geometrie des Wasser-Moleküls besitzt das Wassermolekül einen negativen Pol am Sauerstoffatom und einen positiven Pol an den beiden Wasserstoffatomen wodurch ein Dipol-Molekül entsteht. Entsprechend der Ladung des Ions richten sich die Wassermoleküle um das Ion aus und werden durch elektrostatische Anziehungskräfte an das Ion gebunden. Ungeladene Moleküle wie Ammoniak (NH3) oder Sauerstoff (O2) können die Membran passiv diffundieren, ebenso wie Wasser. Bei der Diffusion von Wasser durch eine Membran spricht man von Osmose – ein Spezialfall der Diffusion.
Angetrieben wird die Diffusion nicht durch das Bedürfnis eines Ausgleichs, sondern durch den Zufall. Stellen wir uns eine semipermeable Membran vor, die zwei Seiten voneinander trennt. Auf der einen Seite befindet sich ein einziges Wassermolekül, während sich auf der anderen Seite 99 Wassermoleküle befinden. Unter der Annahme, dass jedes der 100 Wassermoleküle mit derselben Wahrscheinlichkeit auf die jeweils andere Seite diffundiert ergibt sich, dass der Nettofluss 99-mal größer in die Richtung der Seite mit dem einen Molekül ist. Es ist somit schlichtweg am wahrscheinlichsten, dass sich irgendwann ein Zustand einstellt, bei dem auf beiden Seiten jeweils 50 Wassermoleküle vorhanden sind. Beschrieben wird dieses Phänomen durch das erste Fick´sche Gesetz.
Biologische Membranen sind ein Grundbaustein aller Zellen. Sie grenzen verschiedene Zelltypen, Gewebe und Reaktionsräume voneinander ab. Membranen bestehen aus Lipiden; lange unpolare Kohlenwasserstoffe mit einer polaren Kopfgruppe. Während das Zellinnere, das sogenannte Cytoplasma, eine wässrige Lösung darstellt, ist die das Cytoplasma umgebende Membran ein wasserunlösliches fett. Folglich grenzen sich Membranen vom Rest der Zelle ab, ähnlich wie ein Öltropfen im Dressing. Aufgrund ihrer Hydrathüllen und der Eigenladung können Ionen nicht ohne Weiteres durch Membranen diffundieren.
2.4.2. Der elektrochemische Gradient
Ein wichtiger Begriff ist der elektrochemische Gradient. Der Gradient zwischen dem Blutplasma des Fisches und dem Umgebungswasser beruht auf zwei Gradienten; einem chemischen Gradienten und einem elektrischem Gradienten. Der chemische Gradient resultiert aus der Teilchenanzahl auf jeder Seite und somit auf stochastischen Prozessen, wie bereits zuvor besprochen. Wenn Ionen (geladene Teilchen) ins Spiel kommen, gibt es eine zusätzliche aktive Kraft durch elektrostatische Anziehungskräfte; positive und negative Ladungen ziehen sich gegenseitig an, während sich gleiche Ladungen abstoßen. Das Innere (Cytoplasma) tierischer Zellen ist in der Regel negativer geladen als das äußere Milieu. Das Membranpotential einer tierischen Zelle liegt in der Regel bei -65 mV, sodass der elektrische Gradient die Aufnahme von Kationen wie Ca2+, Na+, K+ und H+ begünstigt.
2.4.3. Der osmotische Druck
Eine wichtige Begrifflichkeit ist der osmotische Druck. Er beschreibt inwiefern das den Fisch umgebende Wasser den Fisch zur passiven Wasserabgabe bzw. Wasseraufnahme zwingt. Der osmotische Druck funktioniert dabei in zwei Richtungen: Enthält das Wasser deutlich mehr Ionen und besitzt somit einen höheren Salzgehalt als das Blutplasma des Fisches, so droht der Fisch auszutrocknen, weil er Wasser verliert. Besitzt das Wasser jedoch deutlich weniger Ionen als der Fisch dringt Wasser in ihn ein, bis seine Zellen zu platzen drohen. Um diesen osmotischen Drücken entgegen zu wirken haben Knochenfische spezielle Organe und Strukturen zur Osmoregulation evolviert, wobei sich die genaue Funktion zwischen Meer- und Süßwasserfischen unterscheidet (siehe Abbildung 14). Es gibt drei wichtige Organe bzw. Strukturen, die der Fisch für die Osmoregulation nutzt.
Die Haut stellt eine große Oberfläche dar, über die passiv Wasser ein- bzw. ausdiffundieren kann. In der Epidermis (Haut) sitzen Osmorezeptoren, ein spezieller Zelltyp der den osmotischen Druck wahrnimmt. Diese sinnesphysiologischen Zellen, die mit dem zentralen Nervensystem interagieren, kommunizieren mit einem anderen Zelltyp, den man in der Fischhaut finden kann, die sogenannten Becherzellen. Sie bilden den Mukus (Fischschleimhaut), indem sie Muzine nach außen sekretieren. Der Mukus stellt eine unspezifische Barriere gegen den osmotischen Druck dar, da er in beide Richtungen funktioniert. Durch die hohe Viskosität des Mukus diffundieren Wasser und Ionen deutlich schlechter in bzw. aus dem Fisch. Gleichzeitig dient die Schleimhaut auch als Barriere gegen Ektoparasiten, da die viskose Schleimhaut deren Anheftung erschwert. Die Zugabe von Natriumchlorid zum Aquarienwasser bewirkt einen osmotischen Druck, wodurch die Mukussekretion in den Becherzellen angeregt wird. Eine dickere Schleimhaut schützt den Fisch zeitgleich vor dem Anheften neuer Ektoparasiten, weshalb Salzbäder eine altbewährte Methode gegen Ektoparasiten wie Ichthyophthirius multifiliis.
Die Kiemen dienen nicht nur der Atmung, sondern darüber hinaus dem Stoffaustausch zwischen Fisch und Wasser. Sie stellen eine extrem große Oberfläche dar, größer als die Haut selbst. Hier kann ebenso Wasser passiv ein- bzw. ausdiffundieren. Das Kiemenepithel (die äußerste Zellschicht, die mit dem Wasser in Kontakt steht) besitzt spezielle Zelltypen, die der Aufnahme bzw. Abgabe von Ionen wie Na+, K+, Ca2+, NH4+, H+, Cl-, HCO3- und weiteren Ionen dienen. Damit übernehmen die Kiemen vor allem eine wichtige Funktion bei der Osmoregulation, der Regulation des Säure-Base-Haushalts und der Ammoniak-Sekretion. Die Kiemen sind stark durchblutet, sodass die Aufnahme und Abgabe von Ionen und Co. ins bzw. aus dem Blutplasma unmittelbar erfolgt.
In den Nieren wird die Zusammensetzung des Urins aus Ionen und Wasser wohl reguliert und somit der osmotische Druck ausgeglichen. In den Nephronen wird der wässrige Teil des Blutplasmas und kleinere Teilchen wie Ionen, Aminosäuren und Zucker zunächst in die Nierentubuli geleitet, wodurch eine große Menge Primärharn, der Vorläufer des Urins, entsteht. Im weiteren Verlauf werden dem Primärhahn, je nach Bedarf, Wasser, Salze und Nährstoffe entzogen.
Obwohl Meer- und Süßwasserfische in sehr unterschiedlichen Lebensräumen vorkommen und entgegengesetzte osmotische Drücke regulieren müssen, ist die Zusammensetzung des Blutplasmas bei den meisten Fischen sehr ähnlich und liegt im Durchschnitt bei einer Gesamt-Osmolarität von 250 bis 350 mOsmol/L (siehe Tabelle 3). Im Blutplasma dominieren vor allem Natrium und Chlorid den Salzgehalt, mit etwa 150 bis 200 mmol/L. Calcium, Magnesium, Kalium und Hydrogencarbonat liegen im Vergleich dazu lediglich zwischen 1 und 10 mmol/L.
| Art | Habitat | Osmolarität [mOsm/L] |
Ionenkonzentration [mmol/L] |
Referenz | |||||
|---|---|---|---|---|---|---|---|---|---|
| Na+ | K+ | Ca2+ | Mg2+ | Cl- | HCO3- | ||||
| Meerwasser | MW | 1000 | 460 | 10 | 10 | 53 | 540 | 27 | Eckert 2000 |
| Süßwasser | SW | 1 | 0,27 | 0,59 | 0,37 | 0,17 | 0,22 | N.A. | Wetzel 1983 |
| Paralichthys (Flunder) | MW | 337 | 180 | 4 | 3 | 1 | 160 | 0,2 | Eckert 2000 |
| Crassius (Goldfisch) | SW | 293 | 142 | 2 | 6 | 3 | 107 | N.A. | Eckert 2000 |
Schaut man sich die Konzentrationen der verschiedenen Ionen im Süßwasser und im Blutplasma des Fisches an (siehe Tabelle 3), so fällt auf, dass die Diskrepanzen zwischen den Konzentrationen von Fischblut und Süßwasser stark variieren zwischen den verschiedenen Ionen. Während die Kalium-Konzentration im Blutplasma des Goldfisches um das dreifache höher ist, als in den meisten fließenden Süßgewässern, ist die Natrium-Konzentration im Blutplasma des Goldfisches um das 526-fache höher als im Süßwasser. Doch was, wenn das Umgebungswasser eine bestimmte Ionenspezies in höherer Konzentration enthält? Kann es bei einer erhöhten Calcium-Konzentration im Wasser, welche die Ca2+-Konzentration des Blutplasmas übersteigt, zu einem „Calcium-Druck“ kommen? Zumindest in der Theorie kann ein Calcium-Druck entstehen. Eine erhöhte Calcium-Konzentration im Wasser und das negative Membranpotential der tierischen Zelle begünstigen die Calcium-Diffusion in die Zelle entlang des elektrochemischen Gradienten gleich doppelt. Doch die Hydrathüllen und die zweifach positive Ladung des Calcium-Kations verhindern dessen Diffusion durch die Membran. Auch wenn einzelne Ionenspezies im Wasser höher konzentriert sind als im Blutplasma, richtet sich der passive Wasserstrom in Form der Osmose, gegen die alle Fische ankommen müssen, nach dem Gesamt-Druck aller Ionen (siehe Abbildung 15).
Die Aufnahme bzw. Abgabe der verschiedenen Ionen im Kiemenepithel findet stattdessen in speziellen Zellen statt, den sogenannten Ionocyten. Sie stehen in direktem Kontakt mit dem Blut und regulieren den Transport von Ionen aus dem Blut in die Umwelt und umgekehrt. Die Zellseite, die dem Wasser zugerichtet ist, wird als apikale Seite bezeichnet, wohingegen die entgegengesetzte Zellseite, die in Kontakt mit dem Blut steht, als basolaterale Seite bezeichnet wird. Sowohl auf der apikalen als auch der basolateralen Seite ist die Zellmembran dicht gepackt mit Ionentransportern. Ionentransporter sind oftmals sehr spezifisch und erkennen nur bestimmte Ionenspezies, die sie durchlassen. Viele Ionentransporter fungieren als sogenannte Antiporter, indem sie eine Ionenspezies aus der Zelle heraus- und eine andere Ionenspezies in die Zelle hineinpumpen. Grund hierfür ist die Tatsache, dass oftmals ein Transport Energie kostet, während der andere Energie erzeugt. Sobald Ionen gegen ihren elektrochemischen Gradienten transportiert werden, muss die Zelle Energie aufbringen. Werden Ionen entlang ihres elektrochemischen Gradienten transportiert, ist das ein energetisch sehr günstiger Transport, der einen energetisch aufwändigen Transport mitziehen kann. Um auf verschiedene Ionenverhältnisse reagieren zu können besitzen Kiemenepithelzellen häufig verschiedene Ionentransporter, die in unterschiedlicher Anzahl vorhanden sein können. Dabei unterscheidet sich die Ausstattung der Ionocyten hinsichtlich ihrer Ionentransporter zwischen verschiedenen Fischarten, auch solche die derselben Familie angehören, aus gleichen Habitaten wie dem Schwarzwasser zum Teil stark (Sylvain et al. 2023a).
Die Ionocyten lassen sich in zwei Kategorien unterteilen; sie transportieren entweder Kationen wie Na+, H+, K+ und Ca2+, oder Anionen wie Cl- und HCO3- (siehe Abbildung 16). Die einzelnen Ionocyten sind zwischen den respiratorisch aktiven (atmungstätigen) Pflasterzellen in der Epithelschicht eingebettet. Die Epithelzellen in den Kiemen sind durch sogenannte Tight-Junctions miteinander verbunden. Diese Proteinstrukturen vernetzen die vielen Zellen miteinander und dichten das Kiemengewebe zwischen den einzelnen Epithelzellen ab. Zusätzlich existieren sogenannte Gap-Junctions. Hierbei handelt es sich um spezielle Proteinstrukturen, die als Tunnel zwischen verschiedenen Epithelzellen fungieren. Durch sogenannte Integrine, die in die Zellmembran integriert sind, können einzelne Zellen äußere Umweltreize wie den Ionengehalt wahrnehmen und entsprechend darauf reagieren.
2.4.4. Hormonelle Steuerung der Osmoregulation
Die Zusammensetzung der einzelnen Ionentransporter in den Zellmembranen der Ionocyten wird, in Abhängigkeit des Salzgehalts bzw. der Ionenverfügbarkeit im Wasser, reguliert und verändert. Integrine und spezielle Sinneszellen, die sogenannten Osmorezeptoren, nehmen den äußeren Salz- bzw. Ionengehalt wahr und informieren das zentrale Nervensystem, welches bestimmte Drüsen dazu veranlasst Botenstoffe in Form von Hormonen auszuschütten, die bspw. die Bildung bestimmter Ionentransporter in den Ionocyten aktiviert oder inhibiert (siehe Kapitel 2.2.).
Besonders gut untersucht ist diese hormonelle Steuerung der Osmoregulation bei Fischarten, die an ein breites Spektrum verschiedener Salzgehalte angepasst sind und während ihrer Lebenszeit sowohl in Süß-, Brack- als auch Meerwasser leben, den sogenannten euryhalinen Fischarten. Sie machen lediglich 5% aller Knochenfischarten aus, während die restlichen 95% zu den stenohalinen Fischarten zählen, die ihr gesamtes Leben ausschließlich in Süß- oder Meerwasser verbringen (Evans, 1984). Zu den euryhalinen Fischarten zählen auch jene, die für ihre Fortpflanzung zwischen Süß- und Meerwasser wechseln, den sogenannten Wanderfischen. Wanderfische werden in zwei verschiedene Typen unterteilt. Wanderfische, die für die Fortpflanzung vom Meer- ins Süßwasser übergehen, wie beispielsweise Lachse, werden als anadrom bezeichnet. Das Gegenteil stellen die katadromen Wanderfische wie z.B. Aale dar, die ihr Leben primär im Süßwasser verbringen und für die Fortpflanzung ins Meerwasser wandern.
Wissenschaftliche Untersuchungen an Wanderfischen wie dem Lachs zeigten, dass drei Hormone die Osmoregulation maßgeblich koordinieren; Das Wachstumshormon (engl. Growth hormone [GH]), das Stresshormon Cortisol sowie Prolactin. Dabei ist das Wachstumshormon GH dafür zuständig die Ionocyten für die Ionenabgabe im salzhaltigen Meerwasser umzuprogrammieren, während Prolactin das „Süßwasser-Hormon“ ist und die Ionenaufnahme veranlasst (McCormick, 2001). Das Stresshormon Cortisol ist an beiden Umstellungsprozessen beteiligt. So konnte bspw. gezeigt werden, dass das Umsetzen von Coho-Lachsen von Süß- in Meerwasser zu einer Zunahme des Natrium-Spiegels im Blutserum führte, die nach 4 Tage ihr Maximum erreichte, als der Natrium-Spiegel im Blutserum um etwa 28% zunahm. Bereits innerhalb des ersten Tages kam es zu einer sehr kurzfristigen aber hohen Ausschüttung von Cortisol. Ab dem vierten Tag nahm der Natrium-Spiegel im Blutserum wieder ab und war nach 8 Tagen wieder bei seinem Normalwert (Eckert, 2000). Demnach können euryhaline Wanderfische ihre gesamte Osmoregulation binnen einer Woche umkehren.
Für die stenohalinen Arten gibt es deutlich weniger wissenschaftliche Untersuchungen. Jedoch regulieren auch hier Hormone wie Cortisol, Prolactin und GH die Osmoregulation. Dies verschafft auch den Kiemenepithelien der stenohalinen Süß- und Meerwasserfische eine gewisse Plastizität, obgleich diese Plastizität deutlich starrer ausfällt als bei den euryhalinen Fischarten. Für Pterophyllum scalare wurde gezeigt, dass ein pH Abfall von 6,0 auf 3,5 zwar zunächst den Ionenhaushalt (bspw. den Natrium-Spiegel im Blutplasma) stark beeinflusste, dieser sich aber bereits nach 72 Stunden völlig akklimatisierte (Gonzalez & Wilson, 2001). Ebenso akklimatisieren sich Grahams Tilapien (Alcolapia grahami), die in sehr alkalischen und salzhaltigen Seen Kenias leben (pH ~10; ~580 mOsmol/L), in Wasser, das 10 bzw. 200% des natürlichen Salzgehalts im Habitat enthielt, binnen 10 Tage (Wood et al. 2002). Diese Untersuchungen zeigen, dass sich auch stenohaline Arten schnell an sich eine ändernde Salinität oder Alkalinität anpassen können.
2.4.5. Säure-Base-Regulation bei Knochenfischen
Wie in Abbildung 16 dargestellt, ist die Osmoregulation streng gekoppelt an die Säure-Base-Regulation des pH-Werts im Blut. Der Blut pH-Wert liegt normalerweise zwischen 7,0 und 8,0. Nimmt der pH-Wert rapide ab, kann dies zu einer Blutversauerung, der sogenannten Azidose führen. Eine starke Zunahme des pH-Werts kann hingegen zu einer Alkalisierung des Blutes, der sogenannten Alkalose führen. Sowohl die Azidose als auch die Alkalose haben schwerwiegende Auswirkungen auf die Physiologie des Fisches, besonders auf die Atmung. So kann eine Azidose bspw. zum Bohr-Effekt führt. Der Bohr-Effekt beschreibt das Phänomen, dass die Sauerstoff-Affinität des Hämoglobins bei niedrigem pH-Wert abnimmt und somit die Aufnahmegeschwindigkeit des Sauerstoffs vermindert. Bestimmte Arten von Hämoglobinen zeigen bei niedrigem pH, der z.B. durch einen zu hohen CO2-Gehalt entsteht, zusätzlich eine verringerte Sauerstoffbindekapazität, was als Root-Effekt bezeichnet wird.
Fische regulieren ihren Blut-pH, indem sie dem Blutplasma entweder Protonen (H+) entziehen und somit den pH erhöhen, oder sie verringern die Pufferkapazität des Blutes und entfernen Hydrogencarbonat (HCO3-), wodurch der pH-Wert sinkt. In den Ionocyten, die Kationen wie Na+, K+ oder Ca2+ aufnehmen bzw. abgeben, werden auch Protonen abgegeben. Häufig findet ein sogenannter Antiport statt. Protononen werden abgegeben, während Natrium aufgenommen wird. Die Abgabe der Hydrogencarbonat-Anionen findet in Ionocyten statt, die Chlorid aufnehmen, den sogenannten Chloridzellen.
2.4.6. Ammoniak-Exkretion bei Knochenfischen
Die meisten Knochenfische sind ammoniotelisch, was bedeutet, dass sie hauptsächlich Ammoniak bzw. Ammonium ausscheiden und nur wenig bis gar keinen Harnstoff produzieren. Dabei spielt vor allem das Kiemenepithel eine wichtige Rolle, da Fische über die Niere nur wenig Ammoniak/Ammonium ausscheiden (Evans et al. 2005). Im Gegensatz zum positiv geladenen Ammonium-Kation (NH4+) kann das ungeladene Ammoniak-Molekül (NH3) ganz ohne Hydrathülle in der Regel die Membran der Zelle problemlos passieren. Dennoch besitzen viele Fische spezielle Transporter, die entweder Ammoniak oder Ammonium in das Umgebungswasser transportieren können. In Wasser pH <7 reagiert Ammoniak außen sofort zu Ammonium, welches nicht mehr zurück in die Zelle diffundieren kann. Dies führt zu einem Gradienten, der die passive Abgabe des Ammoniaks ermöglicht. In alkalischem und besonders Ammoniak-reichem Wasser kann das Ausscheiden des giftigen Ammoniaks unterdrückt werden, sodass der Fisch an einer Ammoniakvergiftung stirbt. Erst in den Kiemenepithelzellen wird das unproblematische Ammonium in Ammoniak umgewandelt. Eine rasche Entsorgung dieses Abfallprodukts ist für den ammoniotelischen Fisch überlebenswichtig.
2.4.7. Physiologische Adaptationen an das Schwarzwasser
Vergleicht man die Natrium-Transporter aus dem Kiemenepithel verschiedener in Amazonien beheimateter Fische, so fällt auf, dass diese je nach Art unterschiedlich effizient sind. Um die Effizienz eines Natriumionen-Transporters zu bestimmen ermittelt der Biochemiker zwei verschiedene Parameter, Jmax und Km. Jmax ist die maximale Geschwindigkeit des Transporters. Dabei wird die Geschwindigkeit von Ionentransportern dadurch bestimmt wie viele Teilchen (nmol) pro Gramm (g) Proteinmasse (Ionentransporter) pro Stunde (h) transportiert werden können. Eine wissenschaftliche Studie zeigte, dass insbesondere kleinere Salmler wie Paracheirodon axelrodi Ionentransporter mit sehr hohen Geschwindigkeitsraten Jmax in ihren Ionocyten aufweisen (siehe Abbildung 18), während insbesondere größere Cichliden wie Pterophyllum scalare Natriumionen-Transporter besitzen, deren Jmax im Vergleich beinahe nur halb so groß ist. Doch auch die Sensitivität der Ionentransporter ist bei Cichliden herabgesetzt. Die Michaelis-Menten-Konstante Km ist eine wichtige Größe in der Enzymkinetik. Sie beschreibt wie wenige bzw. viele Ionen vorhanden sein müssen, damit die Geschwindigkeit des Transporters 50% seines Maximalwerts (Jmax) erreicht. Je kleiner Km-Wert, desto sensitiver und effizienter sind diese Ionentransporter. Während Natriumionen-Transporter aus P. scalare einen relativ hohen Km-Wert von 136,1 µmol/L aufweisen, liegt der Km-Wert der Natriumionen-Transporter von P. axelrodi bei lediglich 53,7 µmol/L (Gonzalez et al. 2002). Somit erreichen Natriumionen-Transporter aus P. axelrodi nicht nur sehr schnell ihre maximale Transportgeschwindigkeit, sondern weisen auch eine extrem hohe maximale Transportgeschwindigkeit auf.
Das Kiemenepithel und dessen Ionocyten kleiner Salmler aus dem Schwarzwasser scheinen nahezu perfekt an die extreme Ionenärme des Schwarzwasser angepasst zu sein, während größere Buntbarsche aus ähnlich ionenarmen Gewässern weniger effiziente Transporter für die Natriumaufnahme in ihren Kiemen besitzen. Neben der Tatsache, dass es sich um zwei unterschiedliche Fischgruppen mit unterschiedlicher Stammesgeschichte handelt, spielt auch das Oberflächen-Volumen Verhältnis eine wichtige Rolle. Betrachtet man ein Quadrat mit einer Länge a, so wird dessen Fläche durch a2 berechnet. Wird aus diesem zweidimensionalen Quadrat ein kubischer Würfel, lässt sich dessen Volumen mithilfe von a3 berechnen. Während die Fläche um die zweite Potenz zunimmt, nimmt das Volumen um die dritte Potenz zu. Je größer das Volumen eines Körpers wird, desto geringer wird das Verhältnis von Oberfläche zu Volumen. Für Fische bedeutet dies, dass kleine Fische durch ihre vergleichsweise große Kiemen- und Hautoberfläche stärker von osmotischem Druck durch passiven Wasserein- wie -ausfluss betroffen sind als größere Fische. Untersuchungen mit radioaktiv markiertem Wasser zeigten bei Regenbogenforellen (Oncorhynchus mykiss), dass kleinere Tiere mit einem Gesamtgewicht von 13 Gramm durch Osmose, also den passiven Wasserein- und ausstrom über Haut und Kiemen, innerhalb einer Stunde mehr als 100% ihres Körperwasseranteils austauschten, während Regenbogenforellen mit einem Körpergewicht von 50 Gramm nur 34% ihres Körperwasseranteils innerhalb einer Stunde durch Osmose austauschten (Onukwufor & Wood, 2018). Die Diffusionsrate ist somit proportional zum Oberfläche-Volumen Verhältnis eines Fisches. Um dem ständigen enormen osmotischen Druck standzuhalten, besitzen kleine Salmler daher vermutlich sehr effiziente Ionentransporter, um ihren Ionenhaushalt schnell und dauerhaft regulieren zu können. Hinzu kommt, dass große Buntbarsche sich oftmals carnivor ernähren und durch das Fressen von Krebstierchen und anderem Zooplankton eine sehr mineralreiche Nahrung aufnehmen, während omnivore und insbesondere herbivore Fischarten, darunter auch viele kleine Salmler, durch ihre Ernährung deutlich weniger Ionen aufnehmen.

Nicht nur gegen die geringe Ionenverfügbarkeit müssen Schwarzwasserfische ankämpfen. Auch der extrem niedrige pH-Wert, der eine hohe Konzentration an Protonen (H+) anzeigt, stellt die Fische vor eine Herausforderung. In extrem saurem Wasser haben Fische Schwierigkeiten ihre Natrium-Ionen zu behalten, da diese bei niedrigen pH-Werten aus dem Fisch diffundieren. Nicht über die Zellmembran, das verhindern die Hydrathüllen. Natrium kann in extrem sauren Habitaten über sogenannte parazelluläre Wege aus dem Kiemengewebe diffundieren. Die Proteine, welche die einzelnen Zellen des Kiemenepithels zusammenhalten, die sogenannten Tight Junctions, werden in extrem sauren Wasser instabil und es kann vermehrt Natrium austreten, da der Konzentrationsgradient das Austreten in das ionenarme Wasser begünstigt. In extrem sauren und Calcium-armen Umgebungen werden Calcium-Ionen aus den Tight-Junctions gespült, die für deren Stabilität als Cofaktor essentiell sind (Kwong et al. 2014). Infolgedessen kann Natrium über den parazellulären Weg zwischen den Epithelzellen austreten. Für den Trauermantelsalmler Gymnocorymbus ternetzi konnten gezeigt werden, dass dieser bei einer Senkung des pH von 6,5 auf 5,0 die Aktivität seiner Ionentransporter, die Natrium aufnehmen und gleichzeitig gegen H+ austauschen, um das Vierfache erhöhen kann (Gonzalez et al. 1997).
Die Aufnahme von Natrium findet gegen das Konzentrationsgefälle statt und ist deshalb energetisch aufwändig. Die Abgabe von H+ ist bis zu einem gewissen pH-Wert jedoch energetisch so günstig, dass der Austausch von Na+ in den Fisch und H+ aus dem Fisch hinaus ohne das zuführen zusätzlicher Energie funktioniert. In extrem sauren Wasser mit bspw. pH 3,5 finden jedoch sowohl die Aufnahme von Na+ als auch die Abgabe von H+ gegen den Konzentrationsunterschied statt und sind somit energetisch ungünstig. Für den Zebrabärbling (D. rerio) konnte gezeigt werden, dass dieser in extrem sauren Wasser unempfindlich gegen Inhibitoren ist, die die Aktivität der Na+/H+-Austauscher blockieren (Gonzalez et al. 2024). Stattdessen zeigten Clifford et al. 2022, dass D. rerio über Na+/K+-Austauscher verfügt. Das Blutplasma enthält hier höhere Mengen Kalium als das Schwarzwasser, weshalb der energetisch günstige Transport von K+ an das Wasser an die energetisch ungünstige Na+-Aufnahme gekoppelt wird. Der rote Neon (P. axelrodi) hingegen sammelt in seinen Ionocyten Ammonium, das zu Ammoniak und H+ dissoziiert. Aufgrund der dadurch auftretenden hohen H+-Konzentration in den Kiemenepithelzellen, funktionieren hier weiterhin die bekannten Na+/H+-Austauscher (Wood et al. 2014).
Zur pH-Regulation des Blutes müssen Fische H+ abgeben. Dies geschieht zum einen über Ionentransporter, die H+ gegen Na+ austauschen (siehe Abbildung 16). Da sowohl die Aufnahme von Na+, als auch die Abgabe von H+ gegen den Konzentrationsgradienten geschehen muss und deshalb energetisch sehr aufwändig ist, haben viele Fische eine weitere Form entwickelt, um H+ aus dem Blutplasma zu pumpen und an das extrem saure H+-reiche Wasser abzugeben. Fische wie der Zebrabärbling koppeln das Ausscheiden von Ammoniak (NH3) an das Ausscheiden von Protonen (Wright & Wood, 2009). Zwei verschiedene Transporter pumpen Protonen bzw. Ammoniak nach außen (siehe Abbildung 20). Im sauren Schwarzwasser reagieren die herausgepumpten Protonen mit dem Ammoniak zu Ammonium. Das positiv geladene Ammonium-Ion besitzt nun selbst eine Hydrathülle und kann nicht mehr zurück in die Zelle diffundieren. Auf diese Art und Weise entledigt sich der Fisch gleich zweier Abfallprodukte und verhindert deren Rückdiffusion.
Ein weiterer wichtiger Faktor für das Überleben im Schwarzwasser sind die Huminstoffe selbst. Auch die in Amazonien beheimateten Süßwasserrochen (knorpelfische) der Gattung Potamotrygon besitzen recht ineffiziente Natriumionen-Transporter mit niedrigem Jmax und hohem Km. Trotzdem kommen sie endemisch in dem weichen und sauren Wasser Amazoniens vor. In einer wissenschaftlichen Studie wurden Potamotrygon spp. sowohl in saurem und weichen Rio Negro Wasser mit vielen natürlichen Huminstoffen als auch in saurem und weichen Wasser ohne Huminstoffe gehalten (Wood et al. 2003). Bei pH 4 zeigten die Tiere, die ohne Huminstoffe aus dem Rio Negro gehalten wurden, eine deutlich verschlechterte Aufnahme von Natrium und Chlorid. Die Aufnahme von Na+ und Cl- war zu 90% inhibiert. Zusätzlich verloren die Fische im Klarwasser Natrium und Chlorid über die Kiemen. Währenddessen zeigten die Tiere im Rio Negro Wasser deutlich geringere Verluste von Natrium und Chlorid und konnten Natrium und Chlorid weiterhin normal aufnehmen. Die Zugabe von Calcium führte im Klarwasser zu einer deutlichen Besserung der Ionenaufnahme und einem geringeren Ionenverlust. Die Zugabe von Calcium zum Rio Negro Schwarzwasser hatte keinerlei Auswirkung, wahrscheinlich weil die Huminstoffe das Calcium maskierten. Zusätzlich wurde dem Klarwasser ein Huminstoff-Präparat zugeführt, das jedoch nicht ansatzweise zu den gleichen positiven Auswirkungen wie die des Rio Negro Wassers führte. Die Wissenschaftler konstatierten einerseits, dass der Rio Negro spezielle Huminstoffe enthält, die die Ionenaufnahme bzw. -verluste maßgeblich beeinflussten, auf eine unbekannte Art und Weise. Zudem hat auch Calcium einen positiven Einfluss auf die Ionenregulation in den Kiemen in saurem und weichem Wasser. Jedoch wird dieser positive Effekt durch Huminstoffe blockiert.
Zusammenfassend lässt sich festhalten, dass verschiedene Fischgruppen, besonders die kleineren, ganz verschiedene und sehr spezifische Wege gefunden haben, um in extrem weichem und saurem Wasser wie dem Schwarzwasser zu überleben. Dies bedeutet jedoch nicht, dass diese Arten solche extremen Wasserwerte brauchen. Schwarzwasserfische wie P. axelrodi sind nicht acidophil (säureliebend), sondern acidotolerant (Säure tolerierend). Viel mehr besitzen sie die besondere Fähigkeit ihr Kiemenepithel so auszustatten, dass sie auch in lebenswidrigen Habitaten überleben können. Wichtig sind hierfür spezielle Osmorezeptoren, die den Ionengehalt im Wasser wahrnehmen, ebenso wie Integrine. Letztere können jedoch nicht nur chemische Umweltreize wahrnehmen. Integrine können auch Botenstoffe wahrnehmen, die von Mikroorganismen wie Bakterien ausgeschüttet werden (Sylvain et al. 2023a). Wood et al. 2003 führten die positiven Effekte des Rio Negro Wassers auf Potamotrygon spp. bei pH 4 auf die darin gelösten Huminstoffe zurück. Doch die Mikroorganismen, die zum Teil auch im Schwarzwasser leben, spielen womöglich eine zentralere Rolle als die Huminstoffe selbst. Die Bedeutung dieser Mikroben wird im nachfolgenden Kapitel besprochen.
3. Mikroben im Schwarzwasser
3.1. Was sind Mikroben?
Der Begriff „Mikroben“ kennzeichnet kein klares Taxon, also keine Gruppe von Organismen, die alle auf einen direkten gemeinsamen evolutiven Vorfahren zurückzuführen sind. Vielmehr werden unter dem Begriff Mikroben all jene Organismen aufgeführt, die mit bloßem Auge nicht oder kaum zu sehen sind, sondern die nur unter dem Mikroskop sichtbar werden. Hierzu zählen neben Bakterien auch Archaeen, Pilze, Grünalgen und Protisten. Auch wenn diese großen Organismengruppen nicht alle einen direkten gemeinsamen Vorfahren besitzen, leitet sich das Leben, wie wir es kennen, von einem Ur-Vorfahren, der allem Leben auf dem Planeten gemeinsam ist, ab. Dieser letzte universelle Vorfahre, auch LUCA (=“last universal common ancestor“) genannt, ist die Basis von der aus sich der Stammbaum des Lebens rekonstruieren lässt. Die erste Astgabelungen in der Biologie findet zwischen der großen Gruppe der Bacteria und der Gruppe der Archaeen und Eukarya statt. Archaeen und die Eukarya teilen sich einen weiteren gemeinsamen Vorfahren. Gemeinsam bilden Bakterien, Archaeen und Eukarya die drei Domänen des Lebens und damit die erste Stufe aller taxonomischer Einordnungen. Bakterien und Archaeen (zuvor auch Archaebakterien genannt) werden auch als Prokaryoten bezeichnet, da sie keinen Zellkern besitzen. Eukaryoten hingegen besitzen einen Zellkern, in dem sich die Erbinformation in Form der DNA befindet. Zu den Eukaryoten zählen Pflanzen, Pilze, Tiere und diverse Einzeller, die unter dem Begriff „Protisten“ zusammengefasst werden.

Mikroben sind ubiquitär vorhanden. Es gibt keinen Lebensraum, der nicht von Mikroben besiedelt wird. Ob im menschlichen Darm, der ISS oder hydrothermalen Quellen 2000 bis 4000 Metern unter der Meeresoberfläche, in denen das Leben wahrscheinlich seinen Ursprung nahm, überall finden sich verschiedene Mikroben, besonders Prokaryoten. Die Diversität der kleinsten Lebensformen ist umfangreicher als die aller bisher bekannten Mehrzeller. Im Jahre 2016 schaffte es eine wissenschaftliche Publikation aus der Fachzeitschrift Nature Microbiology in die New York Times. Ein Forscherteam um die Wissenschaftlerin Jillian F. Banfield erstellte einen neuen Stammbaum des Lebens auf Grundlage neuer Daten. Das Ergebnis führte zu dem bedeutsamen Fund, dass die Domäne der Bakterien das artenreichste Taxon in der Biologie darstellen (Hug et al. 2016). Seit dem Jahre 2011 nimmt die Entdeckung neuer Bakteriengenome und damit verbunden neuen Arten & Stämmen mithilfe moderner molekularbiologischer Methoden exponentiell zu (Jangid & Prakash 2019). Während das Reich der Tiere 1992 noch 73,1% der Artenvielfalt ausmachte, machte das Tierreich im Jahre 2017 nur noch 7,3% der Artenvielfalt aus, während die Bakterien mit 78% führend waren und nach wie vor sind (Larsen et al. 2017). Doch nicht nur die Diversität von Mikroben, insbesondere Prokaryoten ist beeindruckend. Auch quantitativ machen Mikroben trotz ihrer Winzigkeit einen enormen Anteil aus. Im Jahre 2018 veröffentlichten Bar-On et al. eine Studie, in der die Verteilung der Biomasse auf unserem Planeten bezogen auf verschiedene Organismengruppen untersucht wurde. Hierzu wurde die Verteilung des Kohlenstoffs untersucht. Mit 450 Gigatonnen Kohlenstoff machen Pflanzen 82% der weltweiten Biomasse aus. Auf dem zweiten Platz befinden sich Bakterien, die 70 Gigatonnen der insgesamt etwa 550 Gigatonnen des in Biomasse gebundenen Kohlenstoffs ausmachen. Fische kommen mit 0,7 Gt lediglich auf ein Zehntel dessen.
Man mag fast schon sagen es erscheint logisch, dass Prokaryoten auch in Hinblick auf den Zellstoffwechsel sehr vielseitig sind. Egal ob aerobe Atmung, Gärung, anaerobe Atmung, Kohlenstofffixierung oder Photosynthese, Bakterien haben im Laufe der Evolution unterschiedliche Formen und Kombinationen zur Energiekonservierung entwickelt. Und auch über den essentiellen lebenserhaltenen Primärstoffwechsel hinaus besitzen viele Bakterien interessante Sekundärmetabolismen, die zur Produktion von Antibiotika, Toxinen und anderen biochemischen Hilfsmitteln führen. Bakterien besitzen daher auch ein unfassbar hohes Potential für den Menschen – sowohl im negativen als auch im positiven Sinne.
Aufgrund ihrer vielfältigen Physiologie findet man Prokaryoten auch in extremen ökologischen Nischen. Acidotolerante Prokaryoten zum Beispiel tolerieren auch saure Milieus wie bspw. das in der Biotechnologie genutzte Essigsäurebakterium Gluconobacter oxydans. Neben Prokaryoten, die saure Bedingungen aushalten und überleben, gibt es auch welche, die auf extrem saure Bedingungen (pH < 3) zwangsläufig angewiesen sind, um zu überleben. Man spricht hierbei von acidophilen (säureliebenden) Arten. Hierzu zählt beispielsweise Acidithiobacillus ferrooxidans, der in Erzhalden und sauren Bergwerksabwässern lebt und dort Eisen und Schwefel bei pH Werten < 2 oxidiert. Viele Prokaryoten können jedoch auch weitere Extreme überleben. Sulfolobus solfataricus lebt in vulkanischen Quellen bei pH ~ 2 sowie einer Temperatur von ~80°C und ist damit acidophil und thermophil (hitzeliebend) zugleich. Neben säure- und hitzeliebenden Organismen gibt es auch alkaliphile (laugenliebende), psychrophile (kälteliebende) und halophile (salzliebende) Prokaryoten.
3.2. Interaktionen zwischen Bakterien und tierischen Wirten
Ein wichtiger Lebensraum von Prokaryoten sind andere höhere Organismen, darunter auch Tiere. Der menschliche Darm enthält 100 Billionen Bakterienzellen, das zehnfache der Zellzahl aus der sich der menschliche Körper zusammensetzt. Diese Bakteriengemeinschaft im Darm ist für den Menschen essentiell. Jedoch sind nicht alle den tierischen Körper bewohnenden Mikroorganismen automatisch gut für den tierischen Wirt. Bakterien lassen sich oftmals nicht in „gut“ und „böse“ einteilen. Es gibt symbiontische/probiotische Bakterien, die für andere Organismen förderlich oder gar essentiell sind. Zu diesen „guten“ Bakterien zählen hier beispielsweise Laktobazillen und Bifidobakterien aus dem Darm, da sie die Ausschüttung von Interleukinen (Peptidhormone die als Botenstoffe des Immunsystems dienen) modulieren können, zugunsten des menschlichen Wirtsorganismus (Presti et al. 2015). Die Gesamtheit aller Mikroben, die den Tierkörper besiedeln, nennt man Mikrobiota. Dabei unterscheiden sich die Mikrobiota hinsichtlich ihrer Zusammensetzung, je nach Körperregion und Art. Bei Fischen wird zwischen der Haut-, Kiemen- und Darmmikrobiota unterschieden. Zu diesen Mikrobiota können jedoch auch pathogene (krankheitserregende) Bakterien zählen. Man unterscheidet zwischen obligaten (also immer pathogen) Pathogenen und fakultativ bzw. opportunistischen Pathogenen, die nur in zu großer Anzahl bzw. unter bestimmten Bedingungen Krankheiten auslösen. Obligat pathogene Bakterien, wie z.B. bestimmte Stämme von Streptococcus agalactiae oder Myxobakterien, sind im Aquarium zum Glück eher selten. Auch in der Natur sind es häufig opportunistische Krankheitserreger die bakterielle Infektionskrankheiten und daraus resultierenden Entzündungen verursachen. Arten der Gattungen Flavobacterium (z.B. F. columnare) und Aeromonas (z.B. A. hydrophila) gehören zur normalen Mikroflora, also der kommensalen Mikrobiota, von gesunden Fischen (Derome et al. 2016, Abbott et al. 1992, Trust et al. 1979). Unter normalen Bedingungen sind diese Bakterien nicht pathogen. Verschieben sich die Lebensbedingungen zugunsten dieser Keime, nutzen sie entsprechende Situationen als Opportunisten jedoch aus. Aeromonas hydrophila besitzt, ebenso wie andere opportunistische und obligate Ichthyopathogene, sogenannte Virulenzfaktoren. Diese sind im Erbgut gespeichert und verleihen diesen Bakterien die Möglichkeit einer parasitären Lebensart. Zu den Virulenzfaktoren von Aeromonas hydrophila zählen beispielsweise spezielle Oberflächenstrukturen, sogenannte Fimbrien, mit denen sie besser an tierische Wirtszellen andocken können (Sara und Sleytr 2000). Nur unter der Einwirkungen von Stressoren, die zu einer Schwächung des Immunsystems führen, können sich opportunistische Krankheitserreger wie F. columnare und A. hydrophila als Pathogene ausbreiten (Austin 2006, Boutin et al. 2013). Ebenso spielen die äußeren Umweltbedingungen eine zentrale Rolle. A. hydrophila ist heterotroph und fakultativ anaerob, kann also auch unter Abwesenheit von Sauerstoff leben (Horneman 2015). Ein hoher Nährstoffeintrag verbunden mit einer Sauerstoffarmut führte in Aquakulturen mit Gabelwelsen (Ictalurus punctatus) bereits regelmäßig zu Ausbrüchen von A. hydrophila (Plumb et al. 1976).
Neben den Mikroben, die den Fischkörper besiedeln, interagieren auch andere Mikroorganismen im natürlichen Ökosystem sowie im Aquarium indirekt mit den darin lebenden aquatischen Organismen. Besser gesagt sind es deren Stoffwechselprodukte, die Einfluss auf Fische und Co. nehmen können. Bakterien der Gattungen Nitrospira und Nitrosomonas sind beispielsweise sind wichtige Ammoniumoxidierer, die das von Fischen ausgeschiedene Ammonium weiter zu Nitrat oxidieren. Schwefelreduzierer wie Desulfovibrio desulfuricans sind ebenfalls in Aquarien zu finden. Diese anaerob lebenden Bakterien reduzieren Schwefelverbindungen wie Sulfat zu Schwefelwasserstoff, das im Wasser als Sulfid gelöst ist und toxisch wirkt. Ebenso wie bei Umweltchemikalien gilt auch bei Mikroben der Merksatz des Paracelsus; „Die Dosis macht das Gift“.
3.3. Mikroben im Schwarzwasser?
Die Tropen und insbesondere auch Schwarzwasser-Biotope, wie sie zum Beispiel in Südamerika zu finden sind, beherbergen eine enorme Artenvielfalt an Fischen. Doch wie sieht es mit den ubiquitär vorkommenden und hochdiversen Mikroben, vor allem den Bakterien, aus? Auch in Schwarzwasserbiotopen müssen Stoffkreisläufe wie der Stickstoffkreislauf, der Kohlenstoffkreislauf und der Schwefelkreislauf funktionieren. Dabei sind maßgeblich auch prokaryotische Organismen beteiligt, beispielsweise bei der Nitrifikation und Denitrifikation. Bakterien besiedeln nicht nur die freie Wassersäule in Schwarzwasserbiotopen, sondern auch deren Fischfaunen. In den nachfolgenden Unterkapiteln werden verschiedene Studien vorgestellt, die sich mit Mikroben/Bakterien in südamerikanischen Schwarzwasser-Biotopen beschäftigt haben.
3.3.1. Mikroben im Freiwasser von Schwarzwasser-Biotopen
Die Gesamtkeimzahlen in tropischen Schwarzwasserbiotopen variiert je nach Jahreszeit, Gewässertypus und Wassertiefe, ähnlich wie in anderen Regionen der Welt. Castillo (2000) analysierte die Menge des Bakterioplanktons, also der im freien Wasser schwebenden Bakterien, im Autana-Fluss, einem Schwarzwasserfluss im Orinoco-Becken in Venezuela. Während der Messperiode vom September 1997 bis zum Juni 1998 blieb die Zellzahl quasi konstant bei 1.000.000 (1x106) Zellen pro Milliliter. Die von diesem Fluss gespeisten Seen, wie beispielsweise der Lago Mapuey, wiesen durchschnittlich höhere Gesamtkeimzahlen auf, wobei diese im Jahresverlauf stärker schwankten. Während die Zellzahl im Lago Mapuey im September 1997 und Juni 1998, also den Regenzeiten, bei 1x106 Zellen pro mL betrug, zeigte sich in der Trockenzeit (Februar 1998) eine höhere Gesamtkeimzahl von 2,5x106 Zellen pro mL. An vier verschiedenen Messpunkten des Rio Negro wurden während der Trockenzeit im Dezember 2010 durchschnittlich 0,00762x106 Zellen pro mL nachgewiesen und im Juli 2011 während der Regenzeit lediglich 0,000585x106 Zellen pro mL (Neves 2013). Damit liegt die bakterielle Abundanz im Rio Negro besonders während der Regenzeit deutlich unter den Gesamtkeimzahlen, die man aus anderen Gewässern kennt.
Jedoch gilt es unbedingt zu beachten, dass sich nur wenige Organismen in sogenannten Anreicherungskulturen anziehen lassen. Die Auswahl des Nährmediums, der Temperatur zur Bebrütung, der Sauerstoffeintrag, die Lichtintensität sowie andere Faktoren beeinflussen maßgeblich, ob sich eine Bakterienart kultivieren lässt. Diese veränderten Wachstumsbedingungen im Labor führen dazu, dass sich manche Bakterienarten besser ansiedeln können als andere. So wird beispielsweise ein aerobes Bakterium unter anaeroben Bedingungen nicht wachsen können. Selbst bei der Verwendung verschiedener, standortangepasster Nährmedien und Partnerorganismen als Hilfskomponenten lassen sich heutzutage nur bis zu 30% der Populationen eines Ökosystems durch Kultivierung erschließen (Schink 2017). Neves (2013) nutzte für ihre Bestimmung der Gesamtkeimzahl das Lysogen Broth Komplexnährmedium, das standardmäßig pH 7 aufweist (Bertani 1951), und bebrütete die beimpften Agarplatten für 48 Stunden, ohne unterschiedliche Kultivierungsbedingungen. Bisherige Untersuchungen bildeten demnach noch nicht die Standortbedingungen ab, sodass in den Schwarzwasserbiotopen noch ein unentdecktes mikrobielles Potential steckt.
| Seetyp | See | Zellzahl (x106 pro mL) | Referenz |
|---|---|---|---|
| Oligotroph (nährstoffarm) | Loch Ness | 0,23 - 7,1 | Laybourn-Perry et al. 1994 |
| Mesotroph (mäßig nährstoffreich) | Bodensee | 1 - 12 | Hanisch et al. 1996 |
| Eutroph (nährstoffreich) | Plußsee | 3,7 - 32,6 | Chróst 1993 |
Zudem schwankt auch die Zusammensetzung des Bakterioplanktons in Schwarzwasserflüssen wie dem Rio Negro (Neves 2013). Während des Hochwassers in der Regenzeit dominieren viele methylotrophe Bakteriengattungen, die kurzkettige Kohlenwasserstoffe verstoffwechseln (bspw. Methylobacter, Methylococcus, Methylomonas), Bodenbakterien, die durch überflutete Regenwaldböden eingetragen werden (z.B. Rhizomicrobium, Geothrix, Pedomicrobium) und süßwasserspezifische Gattungen, die typisch für Fließgewässer sind (z.B. Limnohabitans). Während des Niedrigwassers in der Trockenzeit dominieren hingegen Gattungen wie Polynucleobacter, Acinetobacter und Cyanobakterien.
Gelöster organischer Kohlenstoff (dissolved organic carbon; DOC), zu dem auch Huminstoffe zählen, stellt die Grundlage vieler Nahrungsnetze dar. Die Menge an gelöstem DOC, in Form von Huminstoffen, korreliert in den Tropen mit der Häufigkeit bestimmter Bakteriengattungen (Sylvain et al. 2023b). Vor allem Vertreter der Gattung Polynucleobacter kommen vermehrt in Schwarzwasserbiotopen vor, wo 2,25% der gefundenen Bakterien-Gensequenzen auf Polynucleobacter zurückführen sind, während es im Weißwasser 0,65% und 0,14% im Klarwasser sind. Auch die Gattungen Methylobacter und Acinetobacter kommen vermehrt in Schwarzwasserbiotopen vor. Einige Arten der Gattungen Polynucleobacter und Methylobacter besitzen Stoffwechselwege, um Huminstoffe abzubauen und somit den darin gebundenen Kohlenstoff zu nutzen und wieder in den Kohlenstoffkreislauf einzuspeisen. Ebenso wird postuliert, dass kleinere Zerfallsprodukte von Huminstoffen, die durch Lichtenergie abgespalten werden (Photolyse) als Kohlenstoffquelle für Bakterien wie Polynucleobacter, Methylobacter, Acinetobacter und andere dienen können.
3.3.2. Bakteriengemeinschaften (Mikrobiota) der Kiemen, Haut und des Darms südamerikanischer Fische
Die vielfältigen Bakteriengemeinschaften, von denen alle tierischen Organismen besiedelt sind, rücken seit einigen Jahren immer mehr in den Fokus der modernen Mikrobiologie. Diese sogenannten Mikrobiota beeinflussen das Immunsystem, Wachstum und das Verhalten wie beispielsweise Paarungspräferenzen ihrer tierischen Wirte und modulieren somit maßgeblich die Physiologie aller Tiere sowie deren Evolution mit.
Die Ontogenese (Entwicklung) dieser Mikrobiota bei Jungfischen ist insbesondere abhängig von der mikrobiellen Zusammensetzung des umgebenden Wassers. Für den Zebrabärbling Danio rerio konnte gezeigt werden, dass die Darm-Mikrobiota von Jungfischen mehr dem Wasser in der Umwelt ähnelten als adulten Zebrabärblingen, da die Darm-Mikrobiota sich im Laufe der Entwicklung verändern und die Zusammensetzung der Darm-Mikrobiota zwischen adulten Tiere stärker variiert (Stephens et al. 2016). Bei menschlichen Säuglingen sind der Kontakt des Kindes mit der Hautoberfläche der Mutter sowie die Muttermilch als erste Nahrungsquelle des Neugeborenen maßgebliche Faktoren, die die Darm-Mikrobiota des Kindes mitformen. Der im Rio Negro beheimatete Diskusfisch (Symphosodon aequifasciatus) zeigt ein ähnliches Fürsorge-Verhalten wie Säugetiere und hat damit ein einzigartiges Aufzuchtmodell entwickelt, das nur wenige andere Knochenfischarten ebenfalls besitzen. In den ersten drei Wochen ernähren sich die freischwimmenden Diskusjungfische von dem Hautsekret der Elterntiere. Während der Brutpflege ist die Mukusschicht auf der Haut der Elterntiere besonders reich an immunbezogenen Proteinen wie Immunglobulinen, Antikörpern und Hormonen, sodass Bestandteile mit ähnlichen Funktion wie die Inhaltsstoffe der Muttermilch von der Parentalgeneration auf die Filialgeneration weitergibt (Buckley et al. 2010, Chong et al. 2005, Chong et al. 2006, Khong et al. 2009). Doch die Schleimhaut der Elterntiere gibt auch wichtige Mikroben an die nächste Generation weiter. Während die Diskuslarven in den frühen Entwicklungsstadien vor der Aufnahme des elterlichen Hautsekrets (0-3 Tage nach dem Schlüpfen) noch eine Mikrobiota ähnlich des freien Wasser aufwiesen, wie es Stephens et al 2016 zuvor beim Zebrabärbling beobachteten, und das hauptsächlich aus Proteobakterien bestand, verschob sich die Zusammensetzung der Mikrobiota bei den Jungfischen mit Beginn der Aufnahme des elterlichen Hautsekrets (Sylvain und Derome 2017). Alpha-, Beta- und Gammaproteobakterien wurden von Bacterioida und Erysipelotrichi verdrängt. Diese Abfolge mikrobieller Besiedlungsmuster lässt sich auch bei Säugetieren wie dem Menschen beobachten. Umwelt-, Vaginal- und Hautmikroben, mit denen Säuglinge als erstes in Kontakt kommen, siedeln sich normalerweise nicht dauerhaft im Darm von Neugeborenen an. Die Klasse der Bacteroidia ist Teil des Stammes Bacteroidetes, dessen Vertreter bekannt sind als probiotische (gesundheitsfördernde) Darmbakterien, welche die Besiedlung krankheitserregender Mikroben unterdrücken. 21 Tage nach dem Schlupf der Jungfische, wenn die Tiere nicht mehr das Hautsekret der Eltern, sondern Fischfutter fressen, ändert sich die Mikrobiota nochmals. Neben den Bacterioides stieg die relative Häufigkeit der Gattung Cetobacterium, die auch das zweithäufigste Taxon in der Darm-Mikrobiota der adulten Tiere darstellt. Die Darm-Mikrobiota entwickelte sich weiter zu einer adulten Darm-Mikrobiota, indem sie weiter diversifizierte. Durch dieses einzigartige Brutpflegeverhalten bei Symphosodon aequifasciatus weisen die Jungfische des Diskusfische bereits 50 Tage nach dem Schlüpfen eine stabile Darm-Mikrobioate ähnlich adulter Tiere, wohingegen die Darm-Mikrobiota juveniler Zebrabärblinge erst nach etwa 100 Tagen eine stabile Population ähnlich adulter aufweist. Die Weitergabe der parentalen Mikrobiota stellt einen ökologischen Vorteil in der Entwicklung des Diskusfisches dar. Für diese Entdeckung der Ontogenese der Darmmikrobiota bei Diskusjungfischen wurde dem Fischmikrobiom-Ökologen François-Étienne Sylvain sogar der Bill Costerton Award „für Forschung, die am besten neue Theorien in der mikrobiellen Ökologie und eine breitere interdisziplinäre Bedeutung einbezieht“ von der Internationalen Gesellschaft für Mikrobielle Ökologie verliehen. Mit zunehmender Seneszenz verändert sich die Darmmikrobiota und die Diversität nimmt ab, was die Besiedlung opportunistischer Krankheitserreger begünstigt. Ursache könnte ein nicht mehr intaktes Immunsystem sein, welches die kommensale Darmmikrobiota nicht mehr ausreichend schützt. Es kommt zur sogenannten Dysbiose, also einer Veränderung der kommensalen Darmmikrobiota, welche die Gesundheit des Wirtes benachteiligt. Diese Dysbiose, die mit dem Alterungsprozess einher geht, wurde im Türkisen Killifisch (Nothobranchius furzeri) untersucht (Smith et al. 2017). Die Forscher töteten die Darmmikrobiota alter Tiere mittels Antibiotikabehandlungen ab und setzten sie in Aquarien mit jungen Artgenossen. Durch die im Wasser schwimmenden Ausscheidungen nahmen die älteren Tiere Darmmikroben der jüngeren Tiere auf, was zu einer signifikanten Lebensverlängerung der älteren Tiere führte. Diese an Fischen gewonnen Erkenntnisse zeigen eindeutig, dass die Darmmikrobiota sich im Laufe des Lebens ihrer tierischen Wirte maßgeblich verändert und deren Alterung beeinflusst.
Um herauszufinden inwiefern die verschiedenen Gewässertypen Amazoniens die Zusammensetzung der Darm- und Hautmikrobiota beeinflusst, wurden 43 Flaggenbuntbarsche (Mesonauta festivum) und 32 Schwarze Piranhas (Serrasalmus rhombeus) untersucht (Sylvain et al. 2019). Diese beiden Arten zeichnen sich dadurch aus, dass sie in allen Gewässertypen (Weiß-, Klar- und Schwarzwasser) vorkommen. Zwischen den verschiedenen Gewässertypen in den Tropen herrscht ein hydrochemischer Gradient, der sich auch auf die Mikrobiota der Fische auswirkt. Dass Anoxie sowie Säurestress die Fisch-Mikrobiota beeinflussen, wurde bereits in Studien gezeigt (Boutin et al. 2013, Sylvain et al. 2016). Insgesamt reagiert die Darmbakteriengemeinschaft weniger empfindlich auf die hydrochemischen Veränderungen, als die Hautmikrobiota, die ständig mit dem Bakterioplankton der Umwelt in Kontakt steht. Sowohl bei Mesonauta festivus als auch Serrasalmus rhombeus dominierten Gamma- und Alphaproteobakterien die Mikrobiota der Hautschleimhaut, sowohl in Schwarz- als auch Weißwasser, da auch hier diese beiden Bakteriengruppen am häufigsten zu finden waren (Sylvain et al. 2019). Im Darm dominierten in beiden Arten Die wichtigsten Parameter, die die Hautmikrobiota und ihre Zusammensetzung beeinflussen sind die Konzentration an Magnesium, Calcium, Natrium, Kalium, Chlorid, dem pH-Wert sowie der Menge an gelöstem organischen Kohlenstoff. Dahingegen beeinflusst lediglich der pH-Wert des Wassers die Darmmikrobiota der Fische. Hierbei zählten bei beiden Arten Clostridien zu den am häufigsten gefundenen Bakterien, sowie Gammaproteobakterien in Schwarzen Piranhas und Fusobakterien im Flaggenbuntbarsch. Insgesamt haben die phylogenetischen Verwandtschaftsverhältnisse zwischen Fischen einen doppelt so hohen Einfluss auf die Zusammensetzung der Darmmikrobiota wie der Gewässertyp (Leroux et al. 2023). Im Gegensatz zur Hautmikrobiota ist die mikrobielle Gemeinschaft im Darm deutlich mehr miteinander vernetzt. Mikroben im Darm gehen oftmals mutualistische Beziehungen miteinander ein und sind voneinander abhängig. Die Mikroorganismen der Fischhaut sind den äußeren Schwankungen physikochemischer Parameter stärker ausgesetzt, was zu einer höheren Modulation der Hautmikrobiota führt und einen Nachteil darstellt, wenn Mikroben der Hautschleimhaut auf Symbiose-Partner angewiesen sind (Sylvain et al. 2019). Die Mikrobiota von Fischen sind demnach art-, umwelt- und gewebespezifisch.
Ähnlich wie die Haut ist auch das Kiemenepithel ständig dem Wasser in der Umgebung ausgesetzt. Die Kiemenmikrobiota hängt, ebenso wie die Hautmikrobiota, von den physikochemischen Parametern und daraus resultierend dem Bakterioplankton des Wassers ab. Untersuchungen an den im Amazonas beheimateten Fischen Mesonauta festivus, Cichla spp., Triportheus albus und Serrasalmus rhombeus zeigten, dass sich die Kiemenmikrobiota nicht nur zwischen verschiedenen Wassertypen, sondern auch unterschiedlichen Spezies signifikant unterscheidet (Sylvain et al. 2023). Jedoch spielen insbesondere Betaproteobakterien eine wichtige Rolle in der Kiemenmikrobiota aller Fische. Besonders die den Betaproteobakterin angehörige Gattung Aquiatalea war in drei der vier untersuchten Arten im Schwarzwasser häufiger vorhanden als in anderen Wassertypen. Bakterien der Gattung Aquiatalea sind dafür bekannt, dass sie mit ihren Wirtstieren interagieren und deren Physiologie beeinflussen. Sie produzieren den heterozyklischen Aromaten Indol, der immunologische Prozesse der Wirtstiere beeinflussen kann (Williams et al. 2020, Chimerel et al. 2014). Zudem wurde die Möglichkeit postuliert, dass das bakteriell produzierte Indol die Synthese und Aktivität von Ionenkanälen der tierischen Wirten sowie die Durchlässigkeit (Permeabilität) der tierischen Epithelien beeinflussen kann (Chimerel et al. 2013). Neben den Huminstoffen können also auch die auf den Kiemen lebenden Mikroben einen entscheidenden Einfluss auf die Physiologie von Schwarzwasserfischen haben und das Leben in diesen extremen Gewässern überhaupt erst ermöglichen.
In einem weiteren Experiment von Sylvain et al. 2023 wurden junge anexische Zebrabärblinge, also Zebrabärblinge die frei von fremden Mikroben sind und eine bekannte Zusammensetzung von Mikroorganismen aufweisen, in Weiß- und Schwarzwasser gehalten unter Zugabe von Bakterioplankton, das entweder typisch für Schwarz- oder Weißwasser ist (siehe Abbildung 24). Die Ergebnisse dieser Studie zeigten, dass die Sterblichkeitsrate der Zebrabärblinge in dem ionenreicherem und pH-neutralem Weißwasser deutlich geringer war als im Schwarzwasser. In Schwarzwasser mit Weißwasser-Bakterioplankton lag die Sterblichkeitsrate der Zebrabärblinge bei 14%. In sterilem Schwarzwasser, also Schwarzwasser ohne Zugabe von Bakterioplankton, lag die Sterblichkeitsrate sogar bei 19%. Nur in Schwarzwasser, welches auch die typisch im Schwarzwasser vorkommenden Mikroorganismen enthielt, lag die Sterblichkeitsrate bei 4%. Diese Ergebnisse unterstreichen die Hypothese, dass das Überleben von Süßwasserknochenfischen in Schwarzwasser auch erst durch spezielle mikrobielle Interaktionen ermöglicht wird.
3.3.3. Pathogene Mikroben in Schwarzwasser-Biotopen Südamerikas
Parasitäre Wimpertierchen und Plattwürmer wurden bereits mehrfach in tropischen Schwarzwasserbiotopen Südamerikas dokumentiert. Die allgemeine Nährstoffarmut im Schwarzwasser begünstigt wohl eine parasitäre Lebensweise aus evolutionsbiologischer Perspektive. In einer Studie wurden 223 Fische (darunter Paracheirodon axelrodi, Ancistrus hoplogenys, Nannostomus eques und Pterophyllum scalare) aus einem Schwarzwasserzufluss (Igarapé Puxirituba) im mittleren Einzugsgebiet des Rio Negro, Gemeinde Barcelos, Bundesstaat Amazonas, Brasilien, gefangen und parasitologisch untersucht (Tavares-Dias et al. 2010). Die Untersuchung zeigte, dass rund 64% der Tiere mit mindestens einer Parasiten-Art befallen waren (siehe Abbildung 25). Mit knapp 37% waren parasitische Plattwürmer der Familien Monogenea, Gyrodactylidae und Dactylogyridae am häufigsten Vertreten. Am zweithäufigsten mit einer Häufigkeit von 21% wurde der Ektoparasit und Erreger der Weißpünktchenkrankheit Ichthyophthirius multifiliis nachgewiesen. In einer zweiten Studie wurden 1574 Fische aus 35 verschiedenen Arten und 12 verschiedenen Familien im Igarapé Fortaleza Becken im nördlichen Bundesstaat Amapá von Brasilien gefangen und parasitologisch untersucht. Im Schnitt waren 85,7% der gefangenen Tiere mit Parasiten befallen, wobei 80% der Wirtstiere Ichthyophthirius multifiliis, Oodinium pillulare und Tripartiella sp. aufwiesen, welche damit die dominierenden Parasiten waren (Baia et al. 2018). Fische, die aus Weißwasserflüssen gefangen wurden zeigten insgesamt eine höhere Befallsrate von parasitären Plathelminthen, wahrend die Häufigkeit von Ciliaten und Nematoden (Fadenwürmern) in beiden Gewässertypen ähnlich hoch war (Leroux et al. 2023).
Für die Häufigkeit und Diversität bakterieller Krankheitserreger in tropischen Schwarzwasserhabitaten gibt es derzeit jedoch noch keine verlässlichen wissenschaftlichen Daten. Ein Kernproblem hierbei ist die Identifikation auf Arten- bzw. Stammebene, da hierzu zeitintensive molekulargenetische Laboranalysen durchgeführt werden müssen. Die mögliche Abwesenheit bekannter bakterieller Ichthyopathogene in tropischen Schwarzwasserbiotopen bedeutet nicht automatisch, dass dort keine bakteriellen Krankheitserreger vorkommen. Die bisher bekannten pathogenen Fischkeime kennt man quasi ausschließlich aus der Aquakultur, ein Industriezweig, der in der eurozentrierten Forschung einen höheren Stellenwert hat als Grundlagenforschung in den Tropen. Nichtsdestotrotz gibt es derzeit keine Indizien dafür, dass tropische Schwarzwasserhabitate frei von bakteriellen Krankheitserregern sind, oder eine deutlich geringere Zelldichte pathogener Keime aufweisen. Aus der Welt der Aquakulturen sind bakterielle Ichthyopathogene bekannt, die auch bei sauren pH-Werten < 6 leben können (siehe Tabelle 5).
| Pathogen | Wachstum bei pH |
|---|---|
| Lactococcus garvieae | 4,5 - 9,6 |
| Flavobacterium hydatis | 5,5 - 11 |
| Pseudomonas anguilli septica | 5,3 - 9,7 |
| Photobacterium damselae subsp. piscidae | 5,5 - 8,0 |
Der Befall mit parasitären Ciliaten Nyctotherus sp. führte zudem zu einer Dysbiose der Darmmikrobiota, was die gegenseitige Einflussnahme prokaryotischer (bakterieller) und eukaryotischer Mikroben in der Haut-, Kiemen- und Darmmikrobiota von Fischen unterstreicht (Leroux et al. 2023).
4. Schwarzwasser in der Aquaristik
Die Aufbereitung von Aquarienwasser, insbesondere auch zur Herstellung von Schwarzwasser, hat bereits seit mehreren Jahren einen festen Platz in der Aquaristik. Hierzu wird mittels Umkehrosmoseanlagen oder Mischbettvollentsalzern zunächst weiches Wasser (0°dKH & 0°dGH) mit niedriger Leitfähigkeit (<100µS/cm) hergestellt. Dieses demineralisierte Wasser wird bereits für viele Fischarten verwendet, besonders bei aus Südamerika und Südostasien stammenden Arten. Durch die Verwendung von Torf-Kanonen kann dieses demineralisierte Wasser anschließend mit Huminstoffen angereichert und durch die darin enthaltenen Fulvosäuren auf pH-Werte auf bis zu ~pH 4 angesäuert werden. In diesem Schwarzwasser werden viele Kampffische & andere Labyrinther, diverse Zwergcichliden, Killifische sowie Salmler & Welse erfolgreich gepflegt und nachgezogen.

Die Wasseraufbereitung ist kostspielig, zeitintensiv und erfordert eine gewisse Logistik, beispielsweise das Aufstellen von Wasserbehältern zur Bevorratung mit demineralisiertem Wasser. Es erscheint also logisch, dass häufig zunächst der einfachere Weg über die direkte Nutzung des heimischen Leitungswasser ausprobiert wird.
4.1. Bedeutung der Wasserwerte in der Aquaristik
Die Bedeutung der physikochemischen Parameter (Wasserwerte) in der Aquaristik wurde stets heißdiskutiert. Vom pedantischen Wasserwerte-Fetischisten bis hin zum phlegmatischen Wasserwerte-Nihilisten, in puncto Wasserwerte scheiden sich die Geister zum Teil erheblich. Ebenso wie sich die Philosophie einzelner Aquarianer unterscheidet, unterscheidet sich auch deren Erfahrung. Doch wie lassen sich all diese bisher besprochenen theoretischen Grundlagen und Überlegungen nun auf die Aquaristik beziehen? Welchen Schluss können wir daraus ziehen? Gibt es sogenannte Weichwasserfische, die weiches, saures und mit Huminstoffen angereichertes Wasser zwangsläufig benötigen?
Die praktische Erfahrung zeigt nicht nur, dass man klassische Schwarzwasserbewohner in weichem, Huminstoff-reichem Wasser halten kann, sondern dass man Fischarten, die aus entsprechenden Schwarzwasser-Habitaten stammen häufig auch problemlos in mittelhartem, leicht alkalischem Wasser halten kann. Viele südamerikanische Großcichliden, die sich in ihren natürlichen Lebensräumen häufig in weichem, saurem Wasser finden lassen, können auch problemlos in hartem Wasser gehalten werden. Insbesondere bei Buntbarschen mit einer Gesamtlänge von mehr als 20 cm in der adulten Phase, die folglich häufig in Großaquarien mit mehr als 800 Litern Fassungsvermögen gehalten werden, stellt die Zwischenlagerung von demineralisiertem Wechselwasser für einen 50%-igen Teilwasserwechsel eine Herausforderung dar. Für die Haltung des Keilfleckbuntbarsches (Uaru amphiacanthoides) erwies sich eine aufwändige Wasseraufbereitung als nicht notwendig. Uaru amphiacanthoides kommt in recht unterschiedlichen Habitaten des Rio Negro, Rio Urubaxi, Rio Tauari, Rio Tapajos, Rio Arapiuns sowie im überschwemmten Igapó des Lago Tefé vor und wurde in größeren Gruppen sowohl im Schwarzwasser als auch im Klarwasser beobachtet (Goulding et al. 1988, Seidel 1993, Stawikowski und Werner 1998). In einem 960 Liter Aquarium (Maße 200x80x60 cm) ließ sich eine zehnköpfige Gruppe adulter Tiere bei hartem Erftstädter Leitungswasser (20°dGH, pH 7,5) erfolgreich pflegen und vermehren.

Wie in Kapitel 2.4.7 beschrieben, haben große Fische aufgrund ihres Oberflächen-Volumen Verhältnis einen geringeren Wasserverlust als kleinere Fische, die mehr Oberfläche im Vergleich zu ihrem Körpervolumen haben und daher über mehr potentielle Austauschfläche für Osmolyte verfügen. Dass südamerikanische Großcichliden aus Klar- und Schwarzwasserhabitaten (bspw. Uaru amphiacanthoides, Pterophyllum scalare, Mesonauta festivum) ähnlich wie ihre mittelamerikanischen Verwandten auch mit härterem Wasser zurechtkommen, mag also möglicherweise damit begründet werden. Schließlich lassen sich mittelamerikanische Großcichliden wie Trichromis salvini, Petenia splendida und Vieja heterospila sogar in Gewässern mit 69°dGH fangen (Stawikowski und Werner 1998). Doch nicht nur viele aus dem Klar- und Schwarzwasser-stammenden Großcichliden kommen mit mittelhartem bis hartem Leitungswasser zurecht. Auch Zwergcichliden aus ähnlichen Habitaten lassen sich zum Teil im harten Erftstädter Leitungswasser halten. So zum Beispiel Sandhügelcichliden (Biotoecus opercularis), die an Fundorten wie der Lago Curumu (pH 6,6; < 1°dGH und °dKH), einem Ufersee des Rio Cuminá-Mirim (pH 6,0; < 1 °dGH und °dKH) sowie anderen Uferabschnitten von Gewässern mit klarem, bräunlichem (Schwarz-)Wasser wie der Lagoa Tapagem im Trombetas-Einzug oder der Mündungszone des Rio Sanabani (Stawikowski und Werner 2004). Eine Gruppe Biotoecus opercularis lebte bei pH 7,5 und 20°dGH in einem 200 Liter Aquarium (Maße 100x40x50 cm) und laichte dort sogar wiederholt ab. Die Tiere waren vital und zeigten ein arttypisches Verhalten. Trotz der wiederholten Eiablagen schlüpften jedoch keine Jungfische. Ganz im Gegensatz zu den Apistogramma commbrae, die wiederholt Nachkommen hochbrachten im gleichen Wasser. Wolfgang Staeck fing A. commbrae im Einzug des Rio Cuiabá und in der Umgebung der namensgebenden Stadt Corumbá in Brasilien, wo die Tiere in klarem, leicht bräunlichem Wasser bei pH 7,2; <1,5°dGH; <4°dKH; 100µS/cm lebten (Koslowski 2002).

Vergleichen wir die Mittelwerte der Konzentrationen der wichtigen Osmolyte in Süßwasser-Habitaten, dem Blutplasma von Süßwasserknochenfischen und einem Beispiel für hartes Trinkwasser (Gesamthärte = 20°dH) fällt auf, dass die Konzentrationen für Kalium, Magnesium und ganz besonders Natrium und Chlorid sowohl im Süßwasser als auch im Trinkwasser geringer sind als im Blutplasma von Süßwasserknochenfischen (siehe Tabelle 3). Die Konzentrationen von Sulfat und Calcium sind hingegen leicht erhöht, im Gegensatz zu den Blutplasma-Konzentrationen. Jedoch ist hierbei zu beachten, dass diese Unterschiede gering sind und dass es sich bei den angegebenen Blutplasma-Konzentrationen um Mittelwerte für alle Süßwasserknochenfische handelt. Wie in Kapitel 2.4.3 beschrieben, schwankt die Calcium-Konzentration im Blutplasma von Süßwasserknochenfischen zwischen 1,5 und 3 mmol/L. Zudem wird die Calcium-Aufnahme aktiv reguliert, sodass ein kein unkontrolliertes Einströmen Von Calcium-Ionen stattfinden kann. Warum lassen sich manche Fischarten in hartem, leicht alkalischem Wasser trotzdem nicht halten oder nachziehen?
| Medium | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | Osmolalität | Referenz |
|---|---|---|---|---|---|---|---|---|
| Süßwasser | 0,27 | 0,59 | 0,37 | 0,17 | 0,22 | 0,05 | ~1 | Wetzel 1983 |
| Blutplasma | 154 | 2,4 | 1,5 | 1,3 | 134 | 0,4 | 274 | Miles 1971, Watanabe & Takei 2012 |
| Trinkwasser | 0,68 | 0,079 | 2,92 | 0,81 | 1,43 | 1,8 | ~7,7 | Trinkwasseranalyse Erftstadt |
4.1.1. "Falsche" Wasserwerte als Ursache für Krankheiten?
Oft wird postuliert, dass Infektionskrankheiten häufig ein sekundäres Problem sind, das aus falschen bzw. nicht-optimalen Wasserwerten resultiert, oder dass ungünstige Wasserwerte selbst zu Krankheiten führen. In den folgenden Unterkapiteln sollen häufig postulierte Kausalitäten beleuchtet und diskutiert werden.
4.1.1.1. Nephrocalcinose, Lochkrankheit und die Calcium-Homöostase
Insbesondere der Gesamthärte wird in der Aquaristik-Fachliteratur ein hohes Maß an Bedeutung zugeschrieben. Oft ist von „Weich-„ und „Hartwasserfischen“ und von zu hohen bzw. zu niedrigen osmotischen Drücken die Rede. Wie bereits in Kapitel 2.4. besprochen, ist Calcium nicht der primäre Elektrolyt, der den Ionenhaushalt aufrechterhält, sondern Natrium. Obwohl der Calcium-Spiegel im Blutplasma deutlich geringer ist, spielen Ca2+-Ionen eine zentrale Rolle in verschiedenen Stoffwechselprozessen und besonders deren Regulation (Eckert 2000). Entsprechend wichtig ist die Aufrechterhaltung der Calcium-Homöostase.
Wie in Tabelle 3 aufgelistet enthält das Blutplasma der meisten Süßwasserknochenfische etwa 1,5 bis 3,5 mmol/L Calcium. Das entspricht einer Gesamthärte von 8,4 bis 19,6°dH. Somit liegt der Calciumspiegel im Fischblut im mittelharten bis harten Bereich und nicht bei derart weichen Bedingungen wie sie bspw. im Schwarzwasser zu finden sind. Welche Auswirkungen hat eine Gesamthärte, die höher ist als im Ursprungshabitat? Darauf gibt es verschiedene Antworten, die im Nachfolgenden diskutiert werden.
Ein häufiger Einwand bei der Pflege von „Weichwasserfischen“ in härterem Wasser sind „verkalkte Nieren“, fachlich ausgedrückt die Nephrocalcinose. Laut dieser Hypothese führen zu hohe Calcium- und Phosphat-Konzentrationen in den Nierentubuli zur Ausfällung von Calciumphosphaten, das sich in Form von Nierensteinen in den Nierentubuli ablagert und dort die Funktion der Niere, besonders die weitere Ausscheidung von Ca2+-Ionen, einschränkt was zu einem früheren Ableben der Fische führen soll. Roland Bauer beschreibt diesen kausalen Zusammenhang zwischen einer zu hohen Wasserhärte und dem Auftreten einer Nephrocalcinose in seinem Buch „Erkrankungen der Aquarienfische. Tierärztliche Heimtierpraxis, Band 4“ (Bauer 1991), jedoch führt er keinerlei wissenschaftliche Primärquellen an, sodass es sich hierbei um ein bisher nicht bestätigtes Postulat, das er nicht als solches deklariert hat, seitens R. Bauer handelt. Stattdessen führen wissenschaftliche Quellen als Ursache einer Nephrocalcinose zu hohe Kohlenstoffdioxid-Gehalte im Wasser an. Zu viel CO2 im Blut führt zu einer Azidose (Blutversauerung), da sich mit dem CO2 mehr gelöste Kohlensäure im Blut befindet als normal. Die Reaktionsgleich lautet:
CO2 + H2O ↔ H+ + HCO3-
Nach dem Massenwirkungsgesetz und dem Prinzip des kleinsten Zwangs von Le Chatelier verschiebt sich die Reaktion zugunsten der Produkte (H+ und HCO33-), wenn man die Konzentration der Edukte (hier CO2) erhöht. Die Ansäuerung durch die erhöhte Konzentration an H+-Ionen hat zur Folge, dass die Nierentubuli vermehrt Phosphat resorbieren. Phosphat ist der Puffer des Blutes und wird während einer Azidose erhöht. Die Reaktionsgleichungen lauten:
H+ + PO43- ↔ HPO42-
HPO42- ↔ H2PO4-
Verschiebt sich der pH-Wert nun wieder aus der Azidose hin zu einem alkalischem pH-Wert können die freien Phosphat-Ionen mit Calcium-Ionen zu Calciumphosphat (Ca3(PO4)2) ausfallen und so Nierensteine bilden (Minerova et al. 2023). Auch das Ausfällen von Calciumoxalat kann zur Bildung von Nierensteinen führen. Dass eine Hyperkalzämie (ein erhöhter Calcium-Spiegel im Blut) die Ausbildung einer Nephrocalcinose fördert, wurde zwar diskutiert, jedoch gibt es keine wissenschaftlichen Ergebnisse, die eine signifikante Zunahme des Ausbildens einer Nephrocalcinose bei einer Hyperkalzämie darlegen. Bei atlantischen Zuchtlachsen (Salmo salar) wurde die Korrelation zwischen dem Auftreten einer Nephrocalcinose und einer veränderten Blutchemie untersucht (Klykken et al. 2022). Bei einem Stichprobenumfang von 186 Zuchtlachsen, die eine unterschiedlich starke Ausprägung einer Nephrocalcinose zeigten, zeigten 37% einen erhöhten Calcium-Spiegel, 8% wiesen einen geringeren Calcium-Spiegel aus. Eine isotonische Lösung verursacht jedoch keine Hyperkalzämie, es sei denn die Fische werden mit viel zu viel Calcium gefüttert. Langzeituntersuchungen bei Salmoniden haben gezeigt, dass bei erhöhten CO2-Gehalten (>12 mg/L) eine Nephrocalcinose auftreten kann. Gleichzeitig wurde die Nephrocalcinose bei erhöhter Karbonathärte (>11,5°dKH) erst ab 20 mg/L CO2 beobachtet (Dettman 2000). Die Behauptung, dass eine erhöhte Wasserhärte (egal ob Gesamt- oder Karbonathärte) eine Nephrocalcinose begünstigt, wird durch wissenschaftliche Ergebnisse derzeit nicht gestützt.
Neben den Schäden durch eine zu hohe Gesamthärte und somit zu viel Calcium im Wasser wird gleichzeitig ein Mangel an C alcium und Phosphat als eine mögliche Ursache für die sogenannte „Lochkrankheit“ diskutiert. Die Lochkrankheit, auch Kopf- und Seitenlinienerosion (KSE/KSLE) genannt tritt vor allem bei südamerikanischen Cichliden auf, die in der Natur nicht selten auch in Schwarzwasser-Biotopen zu finden sind. Die Lochkrankheit wurde bei diversen Großcichliden beobachtet und dokumentiert, darunter Symphysodon aequifasciatus, Uaru fernandezyepezi, Satanoperca daemon und Heros notatus (Bednarczuk 2014, Dittrich 2017). Aber auch bei kleineren Cichliden wie Mikrogeophagus ramirezi wurden Erosionen im Kopfbereich beobachtet. Die ätiologischen (krankheitsverursachenden) Faktoren sind noch nicht eindeutig identifiziert, jedoch ist es denkbar, dass es mehrere Faktoren gibt, die zu einem ähnlichen symptomatischen Krankheitsbild führen. Geißeltierchen der Gattungen Hexamita und Spironucleus werden unter anderem als Auslöser für KSE angesehen (Bassleer 2018). Neben der erregerbedingten Lochkrankheit sind allerdings auch Mangelerscheinungen eine mögliche Ursache für KSE. Untergasser beobachtete, dass KSE auch bei parasitenfreien Diskusfischen sowie anderen Cichliden, die keine Darmflagellaten aufwiesen, auftrat (Untergasser 2006). Untergasser postulierte, dass das Gewebe an Kopf und Seitlinienorganen nicht nur durch Parasitenbefälle, die die Nährstoffresorption im Darm einschränken, erodiert, sondern auch durch direkte Mangelerscheinungen wie Calcium, Phosphat und Vitamin D.
Vitamin D sind fettlösliche Hormon-ähnliche Stoffe, die sich vom Cholesterin ableiten. Besonders das aktive Vitamin D Calcitriol ist wichtig für die Calcium- und Phosphat-Aufnahme und somit für den Knochenstoffwechsel sowie Immunfunktionen und das Zellwachstum. Es wird aus einem Cholesterin-Derivat synthetisiert. In einem ersten Schritt wird das Vorläufermolekül 7-Dehydrocholesterol durch UV-B-Strahlung in der Haut zu Vitamin D3 (Chocalciferol) umgewandelt. In der Leber wird Chocalciferol zu Calcidiol hydroxyliert. Die Aktivierung findet in der Niere statt, indem Calcidiol durch das Enzym 1α-Hydroxylase zu Calcitriol hydroxyliert wird. Calcitriol diffundiert in die Zellen (bspw. Nierenzellen) und bindet dort an den zytoplasmatischen Vitamin D Rezeptor. Dieser bindet daraufhin an Transkriptionsfaktoren, welche die Genexpression von Calcium-Ionenkanälen und Calcium-Bindeproteinen regulieren.
Die Calcium-Regulation ist hormonell gesteuert. Das Parathormon (PTH) verstärkt die Calcitriol-Ausschüttung und wird bei Calcium-Mangel vermehrt ausgeschüttet. Calcitriol erhöht daraufhin unter anderem die Calcium-Resorption im Darm. Zudem aktiviert es Osteoklasten und mobilisiert Calcium aus dem Knochengewebe, um die Calcium-Homöostase wiederherzustellen. Der Antagonist des Parathormons ist das Peptidhormon Calcitonin. Es vermindert die Aktivität der Osteoklasten (Knochenabbau) und verschiebt die Aktivität somit zugunsten der Osteoblasten (Knochenaufbau). PTH und Calcitonin regulieren ebenso den Phosphat-Spiegel des Blutes.
Es steht fest, dass Süßwasserknochenfische ihre Calcium-Homöostase regulieren können und dass sie in aller Regel darauf angewiesen sind aktiv Calcium aufzunehmen. Ausgehend von hartem Wasser (>14°dGH) ist für die Mehrheit der Süßwasser-Knochenfische jedoch nicht davon auszugehen, dass eine Hälterung in einem solchen Wasser zu Nierenkrankheiten führt. Vielmehr muss der Calcium-Aufnahme durch die Nahrung eine größere Bedeutung zu Teil werden. Futtertiere haben jedoch unterschiedliche Calcium-Gehalte. So wurde für Mehlwürmer (Tenebrio molitor) ein Calciumgehalt von 440 mg/kg Körpergewicht dokumentiert, während adulte Tiere der schwarzbäuchigen Taufliege (Drosophila melanogaster) etwa 1400 mg/kg Körpergewicht enthalten (Finke 2013). Ebenso wird durch die handelsübliche Aquarienbeleuchtung keine UV-B Strahlung (elektromagnetische Strahlung im Wellenlängenbereich von 280–315 nm) ausgestrahlt, die zudem normales Natron-Kalk-Glas nicht passieren kann. Die körpereigene Synthese von Vitamin D3 ist somit in der normalen Aquarienhaltung kaum möglich, sodass es über die Nahrung zugeführt werden muss.
4.1.1.2. Schwarzwasser als keimfreies Medium?
Häufig wird behauptet, dass die niedrige Karbonathärte und der niedrige pH-Wert des Schwarzwassers die entscheidenden physikochemischen Faktoren sind, die zu einer niedrigen Keimdichte führen. Bereits Rolf Geisler stellte die mögliche Keimarmut im Schwarzwasser Mitte des letzten Jahrhunderts zur Diskussion (Geisler 1954). In seinem Artikel „Schwarzwasser aus Sicht der Fische“ griff Stefan Karl Hetz diese Hypothese auf und führte als beweisliefernde Literaturstelle für die Keimarmut im Schwarzwasser das 643 seitenlange Lehrbuch „Allgemeine Mikrobiologie“ von Hans Günter Schlegel aus dem Jahre 1992 an. Wie bereits in Kapitel 3 besprochen, stellen die Mikroben jedoch die größte und artenreichste Organismengruppe dar, sodass eine verallgemeinernde Aussage, dass Prokaryoten grundsätzlich mit einem neutralen/leicht alkalischen pH-Wert besser zurechtkommen, schlichtweg falsch ist. Dass die tropischen Gewässer eigene, vom Gewässertypus abhängende, Mikroben-Gemeinschaften aufweisen, zeigen neuere Untersuchungen. Auch pathogene Bakterien können in sauren Milieus überleben (siehe Tabelle 5). Manche prominente opportunistische Ichthyopathogene sind auch gegen hohe osmotische Drücke geschützt, wie man sie im Schwarzwasser vorfindet. So verfügt Aeromonas hydrophila beispielsweise über spezielle Protein-Lagen auf seiner äußeren Hülle, die vor osmotischem Stress schützen (Sara und Sleytr 2000). Die Hypothese einer Adaption tropischer Schwarzwasserfische an niedrige Keimdichten, hält somit keiner wissenschaftlichen Überprüfung stand. Auch Geisler merkte an, dass es wichtig wäre zusätzlich die Bakterienbestimmung aus tropischen Klar- und Schwarzwässern zu haben. Er unternahm den Versuch destilliertes Wasser in Quarzgefäßen aufzufangen, es mit verschiedenen Ionen anzureichern und mit einem „stark bakterienreichen Wasser“ zu beimpfen. Seine Ergebnisse zeigten, dass das Bakterienwachstum gehemmt wurde, je saurer und weicher das Wasser war (Geisler, 1954). Der beschriebene Versuchsaufbau von Geisler berücksichtigt jedoch nicht um welche Bakterien es sich handelte, die er für sein Experiment nutzte. Es ist davon auszugehen, dass es sich nicht um Schwarzwassermikroben handelte, sondern um klassische Umweltkeime, die in europäischen Gewässern anzutreffen sind. Geisler zeigte damit also, dass das Schwarzwasser für die in unseren Breitengraden und Aquarien vorkommenden Mikroben ungünstige Wachstumsbedingungen darstellen und somit eine bakteriostatische Wirkung hat, die bei der Fischhaltung und Nachzucht im Aquarium definitiv günstig ist.
Wie lässt sich jedoch die Tatsache erklären, dass manche der heiklen „Problemarten“, wenn es sich um deutsche Nachzucht handelt, teilweise auch in neutralem/leicht alkalischem und mittelhartem bis hartem Leitungswasser gut pflegen lassen? Eine Blitz-Evolution hinsichtlich ihrer osmoregulatorischen Fähigkeiten oder genetisch-bedingte Änderungen des Immunsystems sind es nicht. Vielmehr spielen hier die Mikrobiota des Fisches eine zentrale Rolle. Wildfänge, die aus Schwarz-, Weiß- oder Klarwasser gefangen wurden, haben eine an diese Gewässer spezialisierte Haut-, Kiemen- und Darmmikrobiota. Ähnlich wie die Übergänge zwischen den verschiedenen Gewässertypen in den Tropen, führt auch der Übergang aus eben jenen Gewässern in europäische Leitungswässer oftmals zu einer Änderung eben jener Mikrobiota. Dass Stressoren wie Anoxie, falsche Ernährung und physikochemische Einflüsse, wie beispielsweise Säurestress, zu einer vorübergehenden Veränderung in der Zusammensetzung der Mikrobiota führen, wurde in wissenschaftlichen Studien bewiesen (Sylvain et al. 2016). Die Mikrobiota stellen einen wichtigen Teil des Immunsystems dar, da sie der primären, unspezifischen Immunabwehr dienen. Bereits besiedelte Körperoberflächen (egal ob Haut, Kiemen oder Darm) können nicht mehr bzw. deutlich schlechter durch andere pathogene Mikroben besiedelt werden. Der Verlust der Mikrobiota führt unweigerlich zu einem vulnerablen Zustand, in dem die Besiedlungsfläche des Fischkörpers unter Mikroorganismen neu ausgefochten wird. Hier haben pathogene Mikroben die Möglichkeit eine dominierende Funktion einzunehmen. Der Verlust der nicht-pathogenen kommensalen Mikrobiota führt zu einem Anstieg der Häufigkeit potentiell pathogener Keime (Boutin et al. 2013). Nachzuchten haben den Vorteil, dass sie bereits während der ersten Lebenstage mit eben jenen Aquarien-Mikroben in Kontakt treten und eine kommensale Mikrobiota aufbauen können. Im Gegensatz dazu kann das Aufrechthalten einer keimarmen Umgebung im Aquarium als artifizieller Lebensraum für Wildfänge aus tropischen Klar- und Schwarzwässern eine sichere Haltung dieser Fische gewährleisten. Zumindest können die in unseren Breitgraden vorkommenden bakteriellen Ichthyopathogene in saurem und weichem Wasser zum Teil schlechter wachsen. Für Flavobacterium columnare konnte nachgewiesen werden, dass die Pathogenität dieses Erregers von der Wasserhärte abhängig ist. In der Studie von Straus et al. 2015 wurden Gabelwelse (Ictalurus punctatus) mit F. columnare infiziert und in zwei verschiedenen Wässern gehalten. Während die Sterblichkeit der Tiere in Wasser mit 1,28 mmol/L Härtebildner [Ca/Mg] (entspricht etwa 7,17 °dGH) bei 17% lag, lag die Sterblichkeitsrate bei Fischen in einem Wasser mit 0,06 mmol/L Härtebildner [Ca/Mg] (entspricht etwa 0,34°dGH) bei 0%. Ursache hierfür ist, dass die divalenten Erdalkalimetallionen Ca2+ und Mg2+ teilweise für das Anheften der bakteriellen Erreger an die Wirtszelle notwendig sind, indem sie als wichtige Cofaktoren für sogenannte Adhäsine (Anheftungsproteine) dienen.
Diese Idee der Mikrobiota-Änderungen könnte auch eine Erklärung für die sogenannte „Bakterienunverträglichkeit“ darstellen. Sobald Fische mit neuen Wässern und damit oftmals zwangsläufig auch neuen Mikroben in Kontakt kommen, besteht das Risiko für Infektionskrankheiten. Dass auch Nachzuchten, besonders aus südostasiatischen oder osteuropäischen Zuchtfarmen, anfällig für „hohe“ Keimbelastungen sein können, zeigt sich bei diversen Zuchtformen südamerikanischer Zwergbuntbarsche. Bereits 1982 erwähnte Werner Schmettkamp, dass die erfolgreiche Haltung von Mikrogeophagus ramirezi von der Qualität des Zuchtbetriebs aus dem sie stammen abhängt (Schmettkamp 1982). Er postulierte, dass die vitamin-hormon-behandelten Zuchtwässer osteuropäischer Zuchtbetriebe ein Medium schaffen, in dem sich die Tiere vital halten, diese jedoch kränklich werden, sobald sie aus diesem System entnommen und im Heimaquarium gehalten werden. Der Einsatz antibakterieller Stoffe in der Zierfischzucht ist weder neu noch alt, sondern seitjeher bekannt. Der Einsatz von Desinfektionsmitteln wie Formalin, Malachitgrün, Kaliumpermanganat, Methylenblau und Antibiotika wie Chloramphenicol, Oxytetracyclin und Erythromycin wurde wiederholt in südostasiatischen Zierfischfarmen dokumentiert (Chanda et al. 2011). Das Einsetzen solcher Fische in normale Wässer mit moderater Keimdichte führt schnell zu Problemen, da durch den exzessiven Einsatz von antibakteriellen Mitteln auch keine gesunde Kiemen-, Haut- oder Darmmikrobiota und somit keine ausreichende unspezifische Immunabwehr vorhanden ist. Ähnlich wie die europäische Eroberung Amerikas durch Christopher Kolumbus ab dem Jahre 1492 zu zahlreichen Epidemien, die sich schneller ausbreiteten als die europäischen Kolonialherren selbst, bei den Ureinwohnern führte, da diese nie mit Pocken-Erregern (Variola) oder Masern (Morbillivirus) in Kontakt kamen, stellt auch die Umsiedlung südamerikanischer Fische nach Europa einen mikrobiologischen Kulturschock dar.
4.1.1.3. Huminstoffe als obligatorischer Zusatz?
Die Lobpreisung der Huminstoffe nimmt in Zeiten des Online-Marketings stark zu. Selbst die Verbandszeitschrift des Dachverbands deutscher Aquarien- und Terrarienvereine ist vor der Huminstoff-Werbetrommel nicht sicher. Sachlich wird über die vielen Vorteile der Huminstoffe berichtet und am Ende werden Produkte großer Markenhersteller durch deren „wissenschaftliche Mitarbeiter“ angepriesen. Insbesondere Einzelhändler vertreten gerne die Meinung, dass eine Haltung ohne Huminstoffe nicht artgerecht ist, während sich in deren Onlineshops gleichzeitig entsprechende Präparate wiederfinden. Lassen Sie sich davon nicht hinter die Fichte führen! Die positiven Eigenschaften wurden für synthetische Huminstoffe nachgewiesen. Für aus der Natur isolierte Huminstoffe konnte hingegen zum Teil keine positive bzw. nicht jede bisher beschriebene positive Wirkung der Huminstoffe nachgewiesen werden (siehe Kapitel 2.2.1.). Huminstoffe stellen eine riesige heterogene Stoffgruppe dar. Die Anzahl ihrer nützlichen Eigenschaften ist insbesondere auch ihrer Diversität geschuldet. Ob diverse Laub-, Torf- und Holzarten oder Humin-Extrakte jene positive Eigenschaften, die bisher für Huminstoffe dokumentiert wurden, auch wirklich im Aquarium hervorrufen können, ist nicht geprüft. Die Darreichung von Huminstoffen ist dementsprechend nicht obligatorisch, um eine erfolgreiche Haltung zu gewährleisten.
Der Einsatz von Huminstoffen als Arzneimittel wird ebenfalls häufig empfohlen. Auch wenn das pharmazeutische Potential von Huminstoffen durchaus bewiesen und beschrieben ist, haben Naturprodukte wie Huminstoffe den Nachteil, dass sie nur schlecht dosiert werden können. Aufgrund ihrer molekularen Heterogenität gibt es kein einheitliches Molekulargewicht. Die Stoffmengenkonzentrationen können bei gleicher Massenkonzentration stark variieren. Auch ihre Bioaktivität unterscheidet sich stark. Synthetische Huminstoffe, für die eine bioaktive Wirkung gezeigt werden konnte, sind als Arzneimittel-Präparate wohl am zuverlässigsten.
4.1.1.4. Schwankende Wasserwerte: Eustress oder Distress?
Ist Stress zurecht derart verrufen in der Fischhaltung? Ignoriert man die populäre negative Konnotation des Stressbegriffs und entsinnt sich zurück was Stress in der Biologie bedeutet, so kommt man zu dem unweigerlichen Schluss, dass Stress ein unvermeidbarer Bestandteil des Lebens ist. Anpassungsreaktionen sind Teil des Lebens in der Natur. Sie formen maßgeblich die Evolution mit. Ist ein artifizielles stressfreies Leben für unsere Pfleglinge überhaupt erstrebenswert oder gar gesund? Sind gewisse Schwankungen der Wasserwerte womöglich als Eustress anzusehen?
Fischarten wie Gymnogeophagus rhabdatus, Australoheros scitulus, Hyphessobrycon elachys, Scleromystax barbatus oder Apistogramma commbrae entstammen aus Gewässern im südlichen Teil Südamerikas, wo ein subtropisches Klima herrscht. Das Verbreitungsgebiet von Apistogramma borelli erstreckt sich über Argentinien, Bolivien und Brasilien und Paraguay. Hier wurde die Art bei Wassertemperaturen von 6,5°C bis 30°C gefangen (Staeck 1999). Für subtropische Fischarten wie A. borelli ist in der aquaristischen Fachliteratur bereits regelmäßig dokumentiert worden, dass die Tiere vitaler sind und eine höhere Lebenserwartung aufweisen, wenn man diese auch im Aquarium jahreszeitlichen Temperaturschwankungen von mehr als 10°C Temperaturunterschied aussetzt. Für den türkisen Prachtgrundkärpfling (Nothobranchius furzeri) konnte in einer wissenschaftlichen Studie gezeigt werden, dass ökologisch relevante tägliche Schwankungen von 20°C bis 35°C zu einer erhöhten durchschnittlichen Lebenserwartung führten, verglichen mit der Pflege bei einer konstanten Temperatur von 27,5°C (Žák & Reichard 2020). Während bereits nach 175 Tagen die Hälfte der Versuchstiere, die konstant bei 27,5°C gehältert wurden, verstorben war, reduzierte sich die Versuchsgruppe mit den täglichen Temperaturunterschieden erst nach 325 Tagen um 50%. Die täglichen Temperaturschwankungen um 15°C führten zu einer geringeren Körpergröße aufgrund der herabgesetzten metabolischen Aktivität. Jedoch änderte die geringere Körpergröße nichts an der absoluten Eiproduktion der Weibchen. Relativ zur Körpergröße betrachtet waren Weibchen von N. furzeri, die den täglichen Temperaturschwankungen ausgesetzt waren, sogar fruchtbarer als die Weibchen, die konstant bei 27,5°C lebten.

Dass schwankende Wasserparameter, wie auch die Salinität, als Auslöser für die Fortpflanzung dienen können, wurde ebenfalls bereits mehrfach in der aquaristischen Fachliteratur postuliert sowie wissenschaftlich sehr gut für katadrome und anadrome Wanderfische beschrieben. Während der Wanderung der anadromen Lachse vom Meer in ihre im Süßwasser gelegenen Laichplätze verändert sich ihr Hormonhaushalt. Die Hypothalamus-Hyphophyse-Interrenale (HPI) Achse, welche die Ausschüttung der Stresshormone Cortisol sowie Prolaktin und damit unter anderem die Osmoregulation steuert, interagiert mit der Hypothalamus-Hyphophyse-Gonaden (HPG) Achse, welche die Aktivität der Geschlechtsorgane und die Produktion von Gameten steuert. Der Hypothalamus sezerniert das Gonadotropin-freisetzende Hormon, welches die Adenohypophyse anregt die Gonadotropine LH (Luteinisierendes Hormon) und FSH (Follikelstimulierendes Hormon) auszuschütten. Erreichen die Lachse die Flussmündung ihres Laichgewässers ist der FSH-Spiegel erhöht. Das Folikelstimulierende Hormon initiiert die Vitellogenese (Dotterbildung) bei den Weibchen und die Spermatogenese bei Männchen. Das Luteinisierende Hormon nimmt auf dem Weg zum Laichplatz zu und dient der Endreifung der Gameten in den Gonaden, indem es die Synthese weiterer Steroidhormone stimuliert. Kurz vor dem Erreichen des Laichplatzes steigt der Spiegel des Steroidhormons DHP (17α,20β-Dihydroxyprogesteron), das Hormon das für die finale Entwicklung der Gameten und die Ovulation zuständig ist, stark an (Nabi et al. 2014).
Auch in den Tropen ändern sich Wasserparameter wie die Temperatur, der Salzgehalt und die Tageslichtdauer im jahreszeitlichen Verlauf. Die starken Regenfälle in der Regenzeit führen zunächst kühleres Wasser in die Flüsse ein, das relativ ionenarm ist. Schwankungen im Nahrungsangebot, der Wassertemperatur, der Salinität, dem pH-Wert und der Tageslichtdauer können also auch bei unseren Pfleglingen im Aquarium zu einer positiven Stressreaktion führen, die zu einer erfolgreichen Nachzucht führt.
4.1.1.5. Haltung ≠ Nachzucht
Nachdem man nun bisher konstatieren kann, dass die Wasserparameter pH, KH und GH weniger relevant für die Fischhaltung sind, als oftmals dargestellt wird, bleibt jedoch die Frage welchen Einfluss diese Parameter auf die Fortpflanzung hat, abgesehen von ihrer Funktion als Auslöser für Reproduktion. Als Aquarianer ist man schließlich häufig nicht nur an der Haltung von Fischarten interessiert, sondern auch an deren Nachzucht. Während die Haltungsbedingungen bei vielen Arten etwas mehr Spielraum bieten, sind die Bedingungen für eine erfolgreiche Nachzucht häufig enger gesteckt.
Im Gegensatz zu Landwirbeltieren findet bei den meisten Fische eine äußere Befruchtung statt, sodass die Ei- und Samenzellen mit dem umgebenden Wasser in Kontakt kommen und in diesem äußeren Medium zueinanderfinden müssen. Die chemischen Wasserparameter beeinflussen daher nicht nur die Physiologie der Elterntiere, sondern auch die Gameten sowie die aus ihnen entspringenden Embryonen. Im Gegensatz zu den weiblichen Eizellen sind die vom Männchen produzierten Spermien motil (beweglich). Die Spermienmotilität setzt erst ein, wenn die Spermien die Samenflüssigkeit der Hoden verlassen und kann, in Abhängigkeit von der Temperatur von 20-30 Sekunden bis 3-4 Minuten andauern (Lindroth 1946). Die Änderung der osmotischen Verhältnisse im Samenplasma und dem Umgebungswasser lösen die Spermienmotilität aus. Hierbei sind es unterschiedliche Ionen, die die Spermienmotilität bestimmter Fischgruppen beeinflussen. Bei Salmoniden führen hohe Kalium-Konzentrationen zur Inhibition der Spermienmotilität im Samenplasma (Schlenk & Kahmann 1938). Die Verringerung der Kalium-Konzentration aktiviert die Motilität der Spermien von Salmoniden. Bei Cypriniden (Karpfenfisch-ähnliche) hingegen verbessert Kalium die Spermienmotilität zum Teil sogar (Morisawa 1985, Utsugi 1993). Die Spermien des pazifischen Herings (Clupea pallasii) sind in isotonischen Lösungen von Kalium- und Natriumchlorid gleichermaßen aktiv und quasi bewegungslos in Meerwasser. Erst wenn sie in räumlicher Nähe zu einem unbefruchteten Fischei sind, erhöht sich ihre Motilität (Yanagimachi et al. 1992). Spezielle Inhibitor-Moleküle für die Spermienmotilität, wie man sie beispielsweise bei Ratten findet, scheinen bei Fischen nicht vorzukommen. Vielmehr sind es aktivierende Faktoren ausgehend vom Fischei, die die Spermienbeweglichkeit verstärken. Es wurden zwei verschiedene hormonähnliche Gynogamone (griech. gyné = weiblich, gamone = Botenstoffe) bei Fischeiern von Salmo irideus (Regenbogenforelle), C. pallasii & verschiedenen Arten des japanischen Bitterlings gefunden (Hartmann 1944, Koshi & Ogawa 1931, Suzuki 1958). Sie dienen als Lockstoff für Spermien und zur Agglutination (Verklumpung) überschüssiger Spermien nach der erfolgreichen Befruchtung der Eizelle (Hartmann 1944; Hartman et al. 1947a,b; Yamamoto 1961 & Suzuki 1961). Spermienlockstoffe können an Rezeptoren binden und durch den Einstrom von Calcium-Ionen die Spermienmotilität erhöhen. In Calcium- und Magnesium-freien Wasser findet keine Befruchtung von Eizellen des pazifischen Herings C. pallasii statt, da keine Spermienbeweglichkeit induziert wird (Yanagimachi & Kanoh 1953).
Die Aktivität der Spermienlockstoffe beschränkt sich auf eine bestimmte Region auf dem Fischei: dem Mikropylenkanal. Die Mikropyle (griech. mikros = klein, pylé = Tor) ist die Eintrittspforte in der Eihülle (Chorion) für Spermien. Das Chorion ist aus verschiedenen Zonen aufgebaut (Abbildung 12a). Die Zona radiata ist eine nicht-zelluläre Matrix, die reich an Glykoproteinen ist. Sie fungiert als semipermeable Schutzschicht für die Eizelle, die durchzogen von Poren ist. Direkt unterhalb der Zona radiata liegt die Zellmembran der Eizelle. Innerhalb der Eizelle bildet ein Netz aus Aktinfilamenten den Cortex, der die Zellstruktur stabilisiert und in dem spezielle Vesikel, die kortikalen Alveolen, enthalten sind (Kunz 2004). Direkt unterhalb der Mikropyle liegt die Keimscheibe, also die embryonal aktive Region der Eizelle, wo die ersten Zellfurchungen stattfinden. Neben Öl-Globuli enthalten Fischeier sehr viel Dotter (polyecithal), der den Embryo und die Larven im ersten Lebensabschnitt mit Nährstoffen versorgt. Bereits bei Kontakt mit Wasser werden Fischeier aktiviert, indem die Zona radiata verhärtet. Die Verhärtung der Fischeier soll diese schützen und zudem eine Polyspermie, also die Befruchtung der Eizelle von mehr als einem Spermium, verhindern. Bei Kontakt mit Wasser kommt es zu einer Calcium-Welle innerhalb des Fischeis. Durch die Kortikale Reaktion werden die Vesikel innerhalb des Cortex (Cortex Alveolen) geöffnet. Diese setzen große Mengen an Calcium frei. In der Zona radiata werden Poren geschlossen und es bilden sich stabile Disulfidbrücken aus (Ohtsuka 1960). Es wurde außerdem gezeigt, dass Transglutaminasen, die oftmals Calcium als Cofaktor benötigen, die Bildung von Glutamyl-Lysin Isopeptidbindungen und damit die Quervernetzung der Matrix innerhalb der Zona radiata katalysieren (Hagenmeier et al. 1976). Neben dem intrazellulär gespeicherten Calcium wird zudem Calcium aus dem Wasser benötigt, dass durch Poren in das Fischei gelangt. Hierbei dient Calcium in der Zona radiata auch als strukturgebendes Element, indem es ionische Wechselwirkungen erzeugt. Außerdem kommt es zu einem Wassereinstrom in das Fischei, wodurch sich der Perivitellinraum bildet (Abbildung 12b). Er bildet sich aus zwischen der Zona radiata und der Zellmembran der Eizelle. Er baut zusätzlichen Druck auf die Zona radiata aus und schafft eine räumliche Trennung zwischen Zona radiata und Oocyte (Eizelle), sodass die von nachkommenden Spermien zurückzulegende Distanz vergrößert wird. Aus den Alveolen im Cortex werden zudem Mucopolysaccharide sezerniert, die die Viskosität im Perivitellinraum erhöhen und somit die Spermienmotilität behindern.
Unbefruchtete Eier aus dem Eileiter von Forellen können durch eine Masse von 40 Gramm zerdrückt werden (Fisher 1963). Nach Ausbildung des Perivitellinraums halten die Eier bereits knapp 100 Gramm aus und nach zehn Stunden sogar mehr als 5 kg, bis sie nachgeben und kaputt gehen (Gray 1932, Hayes 1942, Hayes & Armstrong 1942, Zotin 1953, Zotin 1958). Lönning et al. 1984 postulierten, dass die Widerstandsfähigkeit von Fischeiern abhängig von ihrem Habitat ist. So sind pelagische Eier i.d.R. weniger belastbar als benthisch lokalisierte Eier, die insbesondere bei starken Strömungen mit Kieseln und Geröll in Kontakt kommen.
Dass die Wasserbeschaffenheit auch bei der Nachzucht im Aquarium eine wichtige Rolle spielt, haben unter anderem Michael Wagner und Andreas Konetzky gezeigt. Sie veröffentlichten in einem Online-Forum einen Artikel „Trinkwasser ist kein Aquariumwasser – Polyphosphate im Trinkwasser und im Aquarium“. Darin dokumentierten sie die verringerte Befruchtungsquote bei der Nachzucht von Melanotaenia maccollochi in Trinkwasser im Vergleich zu Brunnenwasser. Die Wässer hatten dabei ähnliche Parameter bezüglich KH und GH (<1°dH). Schnell machten sie Polyphosphate, die in der Trinkwasseraufbereitung als Korrosionsschutz eingesetzt werden, als vermeintlichen Übeltäter aus. Auch wenn der Versuchsaufbau diesen Schluss nicht zuließ, zeigt dieser Bericht sehr gut, dass Wässer, die für eine erfolgreiche Haltung geeignet sind, nicht automatisch für die Nachzucht geeignet sein müssen. Da Polyphosphate als Korrosionsschutz divalente Kationen wie Calcium maskieren, ist es durchaus denkbar, dass Polyphosphate die kritischen Punkte während der Befruchtung, die Calcium-abhängig sind, inhibiert und dadurch die Befruchtungsquote drastisch senkt. Des Weiteren ist auch eine Aufnahme kurzkettiger Oligophosphate in die Eizelle nicht auszuschließen. Unter natürlichen Bedingungen löst der Membranfaktor Inositol-1,4,5-triphosphat (IP3) die Calcium-Welle im Zuge der Kortikale Reaktion aus (Nuccitelli 1987). Kurzkettige Polyphosphate könnten als Substratanalogon fungieren und einen ähnlichen Einfluss wie IP3 auf die Eizelle haben. Dass Temperaturänderungen, schwankende Ionenverhältnisse und andere chemische Einflüsse den Befruchtungsprozess beeinflussen können, wurde bereits in früheren Studien gezeigt (Kanoh 1953, Devillers et al. 1953, Zotin 1958, Detlaf 1959, Luther 1966, Lönning et al. 1984). Ob auch die Fischeier von aus Schwarzwasser stammenden Fischarten Calcium-Ionen für die Spermienlockung benötigen, ist nicht bekannt. Aufgrund der niedrigen Calcium-Konzentrationen im Schwarzwasser ist es denkbar, dass diese Fischeier an deutlich niedrigere Calcium-Konzentrationen angepasst wurden. Die Inhibition einer effizienten Befruchtung durch zu hohe Calcium-Konzentration im Wasser und eine dadurch verursachte frühzeitige Verhärtung des Fischeis, ist durchaus denkbar.
4.1.2. Wissenschaftliches Denken als Aquarianer
Als engagierter Aquarianer ist man per se ein autodidaktischer Naturforscher. Man beobachtet und studiert das Verhalten der eigenen Pfleglinge, beschreibt das Beobachtete und experimentiert, um die Haltungsbedingungen zu optimieren. Es waren und sind oftmals Aquarianer, die das Verhalten vieler Fischarten dokumentieren, sowohl im Aquarium als auch in deren natürlichen Lebensräumen. Wie jeder gute Naturforscher stellen auch Aquarianer anhand ihrer Erfahrungen und Beobachtungen Hypothesen auf und leiten daraus Leitsätze für die Praxis ab. Hierbei fehlt jedoch zum Teil das Wissen wie man wissenschaftlich arbeitet und Beobachtungen richtig interpretiert. Die Verwendung einer Umkehrosmoseanlage, der Eintrag von Huminstoffen und regelmäßige Wasserwechsel stellen für manche Schwarzwasserfische den Schlüssel einer erfolgreichen Haltung und Zucht dar. Doch lassen sich nun einzelne Parameter als Schlüsselelemente für eine gute Haltung identifizieren? Nein. Die heimischen Aquarien sind häufig ein denkbar schlechter Ort für valide und genaue Experimente. Zu geringer Stichprobenumfang, fehlende Kontrollen und eine Vielzahl ungenauer, womöglich ständig schwankender Variablen. Ist es die geringe Gesamthärte, die zu der objektiven Beobachtung führt, dass die Fische gesünder sind? Oder sind es andere – nicht messbare – Parameter wie die Mikroben-Gemeinschaft, die zu einer besseren Vitalität der Pfleglinge führen? Ist die Beobachtung überhaupt objektiv, oder handelt es sich um eine subjektive Beobachtung, die womöglich auf einem Placebo-Effekt beruht? Experimentieren & Ausprobieren ist wichtig. Nicht umsonst heißt es „Studieren geht über Probieren“. Doch die Schlüsse aus eben jenen Haltungs-Erfahrungen sind begrenzt.
Man mag mich bitte nicht falsch verstehen. Erfahrung ist wichtig und gehört mit anderen Aquarianern geteilt, um Wissen über die Haltung einzelner Arten zu sammeln. Nur so bewegt sich das Hobby Aquaristik weiter, wie all die Jahre zuvor. Allgemeingültige Aussagen, strikte Haltungsempfehlungen oder gar wissenschaftliche Erklärungen zur Physiologie unserer Aquarienbewohner ergeben sich daraus jedoch nicht. Es gibt keine Theorie für eine gelungene Aquaristik oder die Haltung anspruchsvollerer, aus dem Schwarzwasser stammenden, Arten. Wenn Ihnen das theoretische Wissen in diesem Artikel eines nachhaltig vermitteln soll, dann dass wir quasi nichts wissen.
4.1.3. Es gibt mehr kritische Parameter als die Gesamthärte und den pH-Wert
Neben den in Kapitel 4.1.1.5. erwähnten Polyphosphaten gibt es noch weitere Umweltchemikalien, die negative Auswirkungen auf die Fischphysiologie, insbesondere die Reproduktion, haben können. Besonders Umweltchemikalien, die den Hormonhaushalt stören (sogenannte endocrine disrupting chemicals [EDCs]), können sich sehr auf das Fortpflanzungsverhalten und die Befruchtungseffizienz von Wirbeltieren auswirken. Auch in der Vivaristik wurde darüber bereits berichtet (Leitz, 2023). Umweltchemikalien mit hormon-ähnlichen Wirkungen, sogenannte Xenohormone, können den Hormonhaushalt von Wirbeltieren stören. Es gibt verschiedene Umweltchemikalien, die als Xenohormone identifiziert sind. Hierzu zählen bspw. Pflanzenschutzmittel wie Glyphosat, Chemikalien die in der Textil- und Kunststoffindustrie zum Einsatz kommen (Bisphenol A, Phtalate, Parabene und Perfluorochemikalien) sowie medizinisch genutzte Stoffe, die auch in Verhütungsmitteln als Hormon-Analoga vorkommen (z.B. Ethinylestradiol in der Antibabypille).
Untersuchungen zum Einfluss 17-α Ethinylestradiol (EE2) auf Knochenfischen zeigten, dass 2,5 µg pro Gramm Körpergewicht (entspricht 0,00125 Promille) bei männlichen Gambusia affinis zur Produktion von Vitellogenin führten, ein Protein das weibliche Tiere synthetisieren und das Teil des Eidotters ist (Angus et al. 2005). EE2 führt bei Fischen und anderen Wirbeltieren wie dem südafrikanischen Krallenfrosch (Xenopus laevis) zu einer „Verweiblichung“ der Männchen führte und die sexuelle Reproduktion störten (Hoffmann und Kloas 2012). Beim Zebrabärbling führte bereits eine EE2-Exposition von 0,4 ng/L zu einer signifikanten Verringerung der Anzahl abgelegter Eier und deren Schlupfrate (Xu et al. 2008). Während die Kontrollgruppe ohne EE2-Zugabe durchschnittlich >240 Eier pro Becken und Laichperiode (7 Tage) ablegte, von denen mehr als 75% lebensfähig waren, lag die durchschnittliche Anzahl abgelegter Eier pro Aquarium bei der mit 0,4 ng/l EE2 gehaltenen Gruppe bei <80 und nicht mehr als 35 % der Eier waren lebensfähig. Konzentrationen von 2 ng/L und 10 ng/L führten zu einem völligen Reproduktionsversagen bei den Fischen. Auch für andere Fischarten wie den Mangroven-Bachling (Kryptolebias marmoratus) oder den Anemonenfisch Amphiprion ocellaris konnte eine reproduktionsstörende Wirkung nachgewiesen werden, ebenso wie für Bisphenol A (Johnson et al. 2016, Gonzalez et al. 2021, Reis et al. 2022).
Die Trinkwasserverordnung sieht nicht vor die Menge an vorhandenem EE2 zu analysieren. Zudem liegt die vorhergesagte Konzentration ohne schädliche Wirkung (predicted no effect concentration [PNEC]) von 0,035 ng/L sowie die reproduktionsstörenden Konzentrationen bei Fischen (0,4 ng/L) von EE2 deutlich unter der Nachweisgrenze herkömmlicher Laboratorien von 0,5 – 1 ng/L (European Commission, Joint Research Centre 2018). Dass EE2 in deutschem Trink- und Oberflächenwasser vorkommen ist bereits seit über 20 Jahren bekannt. Adler 2001 sowie Kuch und Ballschmitter 2001 berichteten über natürliche und synthetische Östrogene im Trinkwasser, die aus Wasserressourcen und Uferfiltrat stammen. Die maximalen Konzentrationen lagen bei 0,5 und 1,4 ng/L 17α-Ethinylestradiol. Der Einsatz von Umkehrosmoseanlagen in der Aquaristik reduziert nicht nur die Gesamthärte, sondern weitaus mehr Parameter, deren Existenz und Wirkung uns zum Teil möglicherweise (noch) gar nicht bekannt ist.
5. Zusammenfassung & Fazit
Was ist das Geheimnis des Schwarzwassers? Ganz gelüftet ist es wohl noch immer nicht, aber inzwischen hat sich deutlich gezeigt, dass das Leben im Schwarzwasser eher einem Überleben gleicht. Schwarzwasserfische kämpfen in ihrem natürlichen Habitat gegen einen extrem hohen osmotischen Druck an und haben daher zum teil hochspezifische Aufnahmesysteme für Ionen entwickelt. Die Effizienz dieser Ionentransporter bedeutet nicht, dass Schwarzwasserfische extrem weiches und saures Wasser brauchen. Viel eher ist dieses besonders ionenarme Wasser für die äußere Befruchtung der Fischeier im freien Wasser nötig, weshalb die Nachzucht von Schwarzwasserfischen häufig eine Herausforderung für den Aquarianer darstellt. Die Anfälligkeit für Krankheiten vieler Schwarzwasserfische ist wahrscheinlich auf die schon lange bekannte Bakterienunverträglichkeit zurückzuführen. Dabei rührt die ominöse Bakterienunverträglichkeit wohl lediglich daher, dass Fische beim Umsetzen vom Schwarzwasser in deutsches Leitungswasser ein Teil ihrer bakteriellen Flora verlieren, deren Plätze gerne von Krankheitserregern eingenommen werden. Eine gesunde Mikrobiota ist Teil des Immunsystems und schützt vor (opportunistischen) Krankheitserregern.
Literaturverzeichnis
Abbott, S. L., Cheung, W. K., Kroske-Bystrom, S., Malekzadeh, T., & Janda, J. M. (1992). Identification of Aeromonas strains to the genospecies level in the clinical laboratory. Journal of clinical microbiology, 30(5), 1262-1266.
Adler, P., Steger-Hartmann T., Kalbfuss, W. (2001). Vorkommen natürlicher und synthetischer östrogener Steroide in Wässern des süd- und mitteldeutschen Raumes. Acta hydrochem. hydrobiol. 29 (4), 227-241.
Allard, T., Weber, T., Bellot, C., Damblans, C., Bardy, M., Bueno, G., Nascimento, N. R., Fritsch, E. & Benedetti, M. F. (2011). Tracing source and evolution of suspended particles in the Rio Negro Basin (Brazil) using chemical species of iron. Chemical Geology, 280(1-2), 79-88.
Austin, B. (2006). The bacterial microflora of fish, revised. The scientific world journal, 6(1), 931-945.
Austin, B., & Austin, D. A. (2007). Bacterial fish pathogens: diseases of farmed and wild fish. Dordrecht: Springer Netherlands.
Baia, R. R. J., Florentino, A. C., Silva, L. M. A., & Tavares-Dias, M. (2018). Patterns of the parasite communities in a fish assemblage of a river in the Brazilian Amazon region. Acta parasitologica, 63(2), 304-316.
Bar-On, Y. M., Phillips, R., & Milo, R. (2018). The biomass distribution on Earth. Proceedings of the National Academy of Sciences, 115(25), 6506-6511.
Bassleer G. (2018). Kopf- und Seitliniensyndrom/-erosion (KSLS/KSLE), auch Lochkrankheit genannt, bei tropischen Süßwasser- und Meeresfischen und seine Verbindung mit der parasitären Infektion durch Spironucleus und anderen Krankheiten mit einigen Vorschlägen zur Diagnose, Vorbeugung und Heilung. DCG-Informationen 49 (5): 110-115.
Bauer, R. (1991). Erkrankungen der Aquarienfische. Tierärztliche Heimtierpraxis, Band 4. S. 53; Parey, Hamburg, Berlin; ISBN: 3-489-52016-5, D.
Bednarczuk, R. (2014). Mein erfolgreicher Kampf gegen Kopf- und Seitlinien-Erosion am Beispiel von Uaru fernandezyepezi. DCG-Informationen 12 (11): 205-208.
Bertani, G. (1951). Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of Bacteriology, 62(3), 293–300.
Bienertova‐Vasku, J., Lenart, P., & Scheringer, M. (2020). Eustress and distress: neither good nor bad, but rather the same?.BioEssays, 42(7), 1900238.
Boutin, S., Bernatchez, L., Audet, C., & Derôme, N. (2013). Network analysis highlights complex interactions between pathogen, host and commensal microbiota. PloS one, 8(12), e84772.
Buckley, J., Maunder, R. J., Foey, A., Pearce, J., Val, A. L., & Sloman, K. A. (2010). Biparental mucus feeding: a unique example of parental care in an Amazonian cichlid. Journal of Experimental Biology, 213(22), 3787-3795.
Castillo, M. M. (2000). Influence of hydrological seasonality on bacterioplankton in two neotropical floodplain lakes. Hydrobiologia, 437(1), 57-69.
Chanda, M., Paul, M., Maity, J., Dash, G., & Gupta, S. S. (2011). The use of antibiotics and disinfectants in ornamental fish farms of West Bengal, India. Journal of Natural Science, Biology, and Medicine, 2(2), 139.
Chimerel, C., Murray, A. J., Oldewurtel, E. R., Summers, D. K., & Keyser, U. F. (2013). The effect of bacterial signal indole on the electrical properties of lipid membranes. ChemPhysChem, 14(2), 417-423.
Chimerel, C., Emery, E., Summers, D. K., Keyser, U., Gribble, F. M., & Reimann, F. (2014). Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells. Cell reports, 9(4), 1202-1208.
Chong, K., Ying, T. S., Foo, J., Jin, L. T., & Chong, A. (2005). Characterisation of proteins in epidermal mucus of discus fish (Symphysodon spp.) during parental phase. Aquaculture, 249(1-4), 469-476.
Chong, K., Joshi, S., Jin, L. T., & Shu‐Chien, A. C. (2006). Proteomics profiling of epidermal mucus secretion of a cichlid (Symphysodon aequifasciata) demonstrating parental care behavior. Proteomics, 6(7), 2251-2258.
Chróst, R. J. (1993). Microbial enzymatic degradation and utilization of organic matter. In Microbial Ecology of Lake Plußsee (pp. 118-174). New York, NY: Springer New York.
Clifford, A. M., Tresguerres, M., Goss, G. G., & Wood, C. M. (2022). A novel K+‐dependent Na+ uptake mechanism during low pH exposure in adult zebrafish (Danio rerio): New tricks for old dogma. Acta physiologica, 234(3), e13777.
Dawkins, R. (2014). Das egoistische Gen (2. Aufl., mit einem Vorwort von W. Wickler). Springer Spektrum. https://doi.org/10.1007/978-3-642-55391-2
Derome, N., Gauthier, J., Boutin, S., Llewellyn, M. (2016). Bacterial Opportunistic Pathogens of Fish. In: Hurst, C. (eds) The Rasputin Effect: When Commensals and Symbionts Become Parasitic. Advances in Environmental Microbiology, vol 3. Springer, Cham. https://doi.org/10.1007/978-3-319-28170-4_4
Detlaf, T.A. (1959). Die Bedeutung der Ca-ionen für die Aktivierung der Eier von Salmoniden (in Russian) Z. bsc. Biol. (USSR) 20, 184.
Dettman, L. (2000). Einflüsse von Sauerstoff und Kohlendioxid im Wasser auf die Entstehung von Kiemenschwellungen/Kiemenerkrankungen. Fischer & Teichwirt 12, S. 466-469.
Devillers, Ch., Thomopoulos, A., Colas, J. (1953). Différentiation bipolaire et formation de l´espace perivitellin dans l´oeuf de Salmo irideus. Bulletin de la Société Zoologique de la France 78. 462-470.
Dittrich, P. (2017). Krankheiten bei Cichliden. DCG-Informationen 48 (2): 46-48
Eckert, R., Randall, D. J., Burggren, W., & French, K. (2002). Tierphysiologie (R. Apfelbach, Übers., 4. Aufl.). Stuttgart, Deutschland: Thieme. (Original erschienen 2000).
Euent, S., Menzel, R., & Steinberg, C. E. (2008). Gender-specific lifespan modulation in Daphnia magna by a dissolved humic substances preparation. Annals of Environmental Science.
European Commission, Joint Research Centre. (2018). Technical report on the implementation of the Watch List under the Water Framework Directive. Publications Office of the European Union.
Evans, D. H. (1984). “The roles of gill permeability and transport mechanisms in euryhalinity,” in Fish Physiology, Vol. 10, eds W. S. Hoar and D. Randall (Orlando, FL: Academic Press), 239–283.
Evans, D. H., Piermarini, P. M., & Choe, K. P. (2005). The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste. Physiological reviews, 85(1), 97-177.
Finke, M. D. (2013). Complete nutrient content of four species of feeder insects. Zoo biology, 32(1), 27-36.
Fisher, K.C. (1963). The formation and properties of the external membrane of the trout egg. Transactions of the Royal Society of Canada 1. Series IV, Section III, 323-332.
Furch, K. (1984). Water chemistry of the Amazon basin: the distribution of chemical elements among freshwaters. In The Amazon: Limnology and landscape ecology of a mighty tropical river and its basin (pp. 167-199). Dordrecht: Springer Netherlands.
Geisler, R. (1954). Das Wasser in den Tropen und in unseren Aquarien. Die Aquarien und Terrarien-Zeitschrift (DATZ) 7 (6): 150-154.
Gonzalez, R. J., Dalton, V. M., & Patrick, M. L. (1997). Ion regulation in ion-poor acidic water by the blackskirt tetra (Gymnocorymbus ternetzi), a fish native to the Amazon River. Physiological Zoology, 70(4), 428-435.
Gonzalez, R. J., & Wilson, R. W. (2001). Patterns of ion regulation in acidophilic fish native to the ion‐poor, acidic Rio Negro. Journal of Fish Biology, 58(6), 1680-1690.
Gonzalez, R. J., Wilson, R. W., Wood, C. M., Patrick, M. L., & Val, A. L. (2002). Diverse strategies for ion regulation in fish collected from the ion-poor, acidic Rio Negro. Physiological and Biochemical Zoology, 75(1), 37-47.
Gonzalez, J. A., Histed, A. R., Nowak, E., Lange, D., Craig, S. E., Parker, C. G., Kaur, A., Bhuvanagiri, S., Kroll, K. J., Martyniuk, C. J., Denslow, N. D., Rosenfeld, C. S. & Rhodes, J. S. (2021). Impact of bisphenol-A and synthetic estradiol on brain, behavior, gonads and sex hormones in a sexually labile coral reef fish. Hormones and Behavior, 136, 105043.
Goulding, M., Carvalho, M. L., & Ferreira, E. G. (1988). Rio Negro, rich life in poor water. Amazonian diversity and foodchain ecology as seen through fish communities. The Hague (Netherlands) SPB Academic Pub.
Goulding, M., Barthem, R., Ferreira, E. (2003). The Smithsonian Atlas of the Amazon. Library Congress Cataloging, 251 pp.
Gonzalez, R. J., Patrick, M. L., & Val, A. L. (2024). Ion uptake in naturally acidic water. Journal of Comparative Physiology B, 194(5), 685-696.
Goulding, M., Carvalho, M. L., & Ferreira, E. G. (1988). Rio Negro, rich life in poor water. Amazonian diversity and foodchain ecology as seen through fish communities. The Hague (Netherlands) SPB Academic Pub.
Goulding, M., Barthem, R., Ferreira, E. (2003). The Smithsonian Atlas of the Amazon. Library Congress Cataloging, 251 pp.
Gray, J. (1932). The osmotic properties of the egg of the trout (Salmo fario). Journal of experimental Biology 9, 277-299.
Hagenmeier, H.E., Schmitz, I., Foles, J. (1976). Zum Vorkommen von Isopeptidbindungen in der Eihülle der Regenbogenforelle Salmo gairdneri Rich., as a metalloenzyme. Hoppe Seyler´s Zeitschrift für Physiologische Chemie 357, 1435-1438.
Hanisch, K., Schweitzer, B., & Simon, M. (1996). Use of dissolved carbohydrates by planktonic bacteria in a mesotrophic lake. Microbial ecology, 31(1), 41-55.
Hartmann, M. (1944). Befruchtungsstoffe (Gamone) bei Fischen (Regenbogenforelle). Die Naturwissenschaften 32, 231.
Hartmann, M., von Medem, F.G., Kuhn, K., Bielig, H.-J. (1947a). Über die Gynogamone der Regenbogenforelle. Die Naturwissenschaften 34, 25-26.
Hartmann, M., von Medem, F.G., Kuhn, K., Bielig, H.-J. (1947b). Untersuchungen über die Befruchtungsstoffe der Regenbogenforelle. Zeitschrift für Naturforschung 2B, 330-349.
Hayes, F. (1942). The hatching mechanism of salmon eggs. Journal of experimental Zoology 89, 357-373.
Hayes, F., Armstrong, F. (1942). Physical change in the consistuent part of developing salmon eggs. Canadian Journal of Research, sect. D 20, 99-114.
Hetz, S. K. (2005). Schwarzwasser – aus der Sicht der Fische. Die Aquarien und Terrarien Zeitschrift (DATZ) 58 (9): 24-29.
Hoffmann, F., & Kloas, W. (2012). Estrogens can disrupt amphibian mating behavior. PloS one, 7(2), e32097.
Horbe, A., & Santos, A. G. (2009). Chemical composition of black-watered rivers in the western Amazon Region (Brazil). Journal of the Brazilian Chemical Society, 20, 1119-1126.
Horneman, A. J. (2015). Aeromonas. Manual of clinical microbiology, 752-761.
Hug, L. A., Baker, B. J., Anantharaman, K., Brown, C. T., Probst, A. J., Castelle, C. J., Butterfield, C. N., Hernsdorf, A. W., Amano, Y., Ise, K., Suzuki, Y., Dudek, N., Relman, D. A., Finstad, K. M., Amundson, R., Thomas, B. C. & Banfield, J. F. (2016). A new view of the tree of life. Nature microbiology, 1(5), 1-6.
Jangid, A., & Prakash, T. (2019). Microbial Genome Diversity and Microbial Genome Sequencing. Microbial Genomics in Sustainable Agroecosystems: Volume 1, 175-201.
Johnson, E. L., Weinersmith, K. L., & Earley, R. L. (2016). Changes in reproductive physiology of mangrove rivulus Kryptolebias marmoratus following exposure to environmentally relevant doses of ethinyl oestradiol. Journal of Fish Biology, 88(2), 774-786.
Kanoh, Y. (1953). Über den japanischen Hering (Clupea pallasii) II. Veränderung im Ei bei Befruchtung und Aktivierung. Cytologia 18, 67-69.
Khong, H. K., Kuah, M. K., Jaya-Ram, A., & Shu-Chien, A. C. (2009). Prolactin receptor mRNA is upregulated in discus fish (Symphysodon aequifasciata) skin during parental phase. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 153(1), 18-28.
Klykken, C., Reed, A. K., Dalum, A. S., Olsen, R. E., Moe, M. K., Attramadal, K. J. K., & Boissonnot, L. (2022). Physiological changes observed in farmed Atlantic salmon (Salmo salar L.) with nephrocalcinosis. Aquaculture, 554, 738104.
Koshi, M., Ogawa, Y. (1951). Studies of fertilization. Separation and chemical formula of activation and chemotaxis substance of sperm from the Clupea pallasii eggs. (in Japanese). Medicine and Biology 18, 184-187.
Koslowski, I. (2002). Die Buntbarsche Amerikas Band 2 Apistogramma & Co. Landbuch Verlag. S. 148.
Kuch, H. M., Ballschmiter, K. (2001). Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environ Sci Technol 35(15), 3201-3206.
Kulikova, N. A., Perminova, I. V., Badun, G. A., Chernysheva, M. G., Koroleva, O. V., & Tsvetkova, E. A. (2010). Estimation of uptake of humic substances from different sources by Escherichia coli cells under optimum and salt stress conditions by use of tritium-labeled humic materials. Applied and Environmental Microbiology, 76(18), 6223-6230.
Kunz, Y.W. (2004). Egg envelope. In: Developmental Biology of Teleost Fishes. Fish & Fisheries Series, vol 28. Springer, Dordrecht. https://doi.org/10.1007/978-1-4020-2997-4_5
Kwong, R. W., Kumai, Y., & Perry, S. F. (2014). The physiology of fish at low pH: the zebrafish as a model system. Journal of Experimental Biology, 217(5), 651-662.
Larsen, B. B., Miller, E. C., Rhodes, M. K., & Wiens, J. J. (2017). Inordinate fondness multiplied and redistributed: the number of species on earth and the new pie of life. The Quarterly Review of Biology, 92(3), 229-265.
Laybourn-Parry, J., Walton, M., Young, J., Jones, R. I., & Shine, A. (1994). Protozooplankton and bacterioplankton in a large oligotrophic lake—Loch Ness, Scotland. Journal of plankton research, 16(12), 1655-1670.
Leitz, T. (2023). Umweltchemikalien als künstliche Hormone und deren Wirkung auf niedere Wirbeltiere. vda-aktuell 2023(4), 34-39.
Leroux, N., Sylvain, F. E., Holland, A., Luis Val, A., & Derome, N. (2023). Gut microbiota of an Amazonian fish in a heterogeneous riverscape: integrating genotype, environment, and parasitic infections. Microbiology Spectrum, 11(5), e02755-22.
Lindroth, A. (1946). Zur Biologie der Befruchtung und Entwicklung beim Hecht. Mitteilungen der Anstalt für Binnenfischerei bei Drottingholm, Stockholm, pp. 1-174.
Lönning, S., Kjörsvik, E., Davenport, J. (1984). The hardening process of the egg chorion of the cod. Journal of Fish Biology 24, 505-522.
MacCreagh, G. (2001). White waters and black. University of Chicago Press.
McCormick, S. D. (2001). Endocrine control of osmoregulation in teleost fish. American zoologist, 41(4), 781-794.
Meinelt, T., Schreckenbach, K., Knopf, K., Wienke, A., Stüber, A., & Steinberg, C. E. (2004). Humic substances affect physiological condition and sex ratio of swordtail (Xiphophorus helleri Heckel). Aquatic Sciences, 66, 239-245.
Menzel, R., Stürzenbaum, S., Bärenwaldt, A., Kulas, J., & Steinberg, C. E. (2005). Humic material induces behavioral and global transcriptional responses in the nematode Caenorhabditis elegans. Environmental science & technology, 39(21), 8324-8332.
Miles, H. M. (1971). Renal function in migrating adult coho salmon. Comp. Biochem. Physiol. 38, 787–826.
Morisawa, M. (1985). Initiation mechanism of sperm motility at spawning in teleosts. Zoological Science 2, 605-615.
Nabi, G., Amin, M., Ullah, N., & Ahmed, N. (2014). An over view on the causes, types and role of hormones in fish migration. International Journal of Scientific & Engineering Research, 5(8), 404-412.
Neves, R. de O. (2013). Caracterização da microbiota bacteriana da água do rio Negro em diferentes períodos sazonais (Masterarbeit, Universidade Federal do Amazonas, Manaus, Brasilien).
Nucitelli, R. (1987). The wave of activation current in the egg of medaka fish. Develpomental Biology 122, 522-534.
Ohtsuka, E. (1960). On the hardening of the chorion of the fish egg after fertilization. III. The mechanism of chorion hardening in Oryzias latipes. Biological Bulletin (Woods Hole, Mass) 118, 120-128.
Onukwufor, J. O., & Wood, C. M. (2018). The osmorespiratory compromise in rainbow trout (Oncorhynchus mykiss): the effects of fish size, hypoxia, temperature and strenuous exercise on gill diffusive water fluxes and sodium net loss rates. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 219, 10-18.
Plumb, J. A., Grizzle, J. M., & Defigueiredo, J. (1976). Necrosis and bacterial infection in channel catfish (Ictalurus punctatus) following hypoxia. Journal of wildlife diseases, 12(2), 247-253.
Presti, I., D’orazio, G., Labra, M., La Ferla, B., Mezzasalma, V., Bizzaro, G., Giardina, S., Michelotti, A., Tursi, F., Vassallo, M. & Di Gennaro, P. (2015). Evaluation of the probiotic properties of new Lactobacillus and Bifidobacterium strains and their in vitro effect. Applied microbiology and biotechnology, 99, 5613-5626.
Reis, R. E., Albert, J. S., Di Dario, F., Mincarone, M. M., Petry, P., & Rocha, L. A. (2016). Fish biodiversity and conservation in South America. Journal of fish biology, 89(1), 12-47.
Reis, L. D. P. G., Lora-Benítez, A. J., Molina-López, A. M., Mora-Medina, R., Ayala-Soldado, N., & Moyano-Salvago, M. D. R. (2022). Evaluation of the toxicity of Bisphenol A in reproduction and its effect on fertility and embryonic development in the zebrafish (Danio rerio). International Journal of Environmental Research and Public Health, 19(2), 962.
Saint-Paul, U., Zuanon, J., Correa, M. A. V., García, M., Fabré, N. N., Berger, U., & Junk, W. J. (2000). Fish communities in central Amazonian white-and blackwater floodplains. Environmental biology of fishes, 57, 235-250.
Sára, M., & Sleytr, U. B. (2000). S-layer proteins. Journal of bacteriology, 182(4), 859-868.
Schink, B. (2017). Die Rolle von Mikroorganismen im Stoffkreislauf und in der Natur. In G. Fuchs (Hrsg.), Allgemeine Mikrobiologie (10. Aufl., Kapitel 18, S. 598–637). Georg Thieme Verlag.
Schmettkamp, W. (1982). Die Zwergcichliden Südamerikas. S. 147 Landbuch-Verlag, Hannover, D.
Seidel, C. (1993). Uaru amphiacanthoides. DCG-Informationen 24: 127-132.
Smith, P., Willemsen, D., Popkes, M., Metge, F., Gandiwa, E., Reichard, M., & Valenzano, D. R. (2017). Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. elife, 6, e27014.
Staeck, W. (1999). Ein Zwergbuntbarsch der Subtropen: Apistogramma borelli. Aquarium Heute 1, 248-252.
Stawikowski, R., Werner, U. (1998). Die Buntbarsche Amerikas Band 1. Landbuch Verlag.
Stawikowski, R., Werner, U. (2004). Die Buntbarsche Amerikas Band 3: Erdfresser, Hecht- und Kammbuntbarsche. Landbuch Verlag.
Steinberg, C. E., Saul, N., Pietsch, K., Meinelt, T., Rienau, S., & Menzel, R. (2007). Dissolved humic substances facilitate fish life in extreme aquatic environments and have the potential to extend the lifespan of Caenorhabditis elegans. Annals of Environmental Science.
Stephens, W. Z., Burns, A. R., Stagaman, K., Wong, S., Rawls, J. F., Guillemin, K., & Bohannan, B. J. (2016). The composition of the zebrafish intestinal microbial community varies across development. The ISME journal, 10(3), 644-654.
Straus, D. L., Farmer, B. D., Beck, B. H., Bosworth, B. G., Torrans, E. L., & Tucker, C. S. (2015). Water hardness influences Flavobacterium columnare pathogenesis in channel catfish. Aquaculture, 435, 252-256.
Suzuki, R. (1958). Sperm activation and aggregation during fertilization in some fishes. I. Behavior of spermatozoa around the micropyle. Embryologia 4, 93-102.
Suzuki, R. (1961). Sperm activation and aggregation during fertilization in some fishes. VII. Separation of the sperm-stimulating factor and ist chemical nature. Japanese Journal of Zoology 13, 79-100.
Sylvain, F. É., Cheaib, B., Llewellyn, M., Correia, T. G., Fagundes, D. B., Val, A. L., & Derome, N. (2016). pH drop impacts differentially skin and gut microbiota of the Amazonian fish tambaqui (Colossoma macropomum). Sci Rep 6: 32032.
Sylvain, F. É., & Derome, N. (2017). Vertically and horizontally transmitted microbial symbionts shape the gut microbiota ontogenesis of a skin-mucus feeding discus fish progeny. Scientific reports, 7(1), 5263.
Sylvain, F. É., Holland, A., Audet‐Gilbert, É., Luis Val, A., & Derome, N. (2019). Amazon fish bacterial communities show structural convergence along widespread hydrochemical gradients. Molecular Ecology, 28(15), 3612-3626.
Sylvain, F. É., Holland, A., Bouslama, S., Audet-Gilbert, É., Lavoie, C., Val, A. L., & Derome, N. (2020). Fish skin and gut microbiomes show contrasting signatures of host species and habitat. Applied and environmental microbiology, 86(16), e00789-20.
Sylvain, É.-F-, Leroux, N., Normandeau, E., Custodio, J., Mercier, P.-L., Bouslama, S., Aleicia, H., Danilo, B., Val, A. L. & Derome, N. (2023a). Important role of endogenous microbial symbionts of fish gills in the challenging but highly biodiverse Amazonian blackwaters. Nature Communications, 14(1), 3903.
Sylvain, F. É., Bouslama, S., Holland, A., Leroux, N., Mercier, P. L., Val, A. L., & Derome, N. (2023b). Bacterioplankton communities in dissolved organic carbon-rich Amazonian black water. Microbiology Spectrum, 11(3), e04793-22.
Sylvain, F. É., Thomas, A., & Derome, N. (2024). Amazonian Fish and Their Bacterial Symbionts: An Intricate Co-Dependence Relationship in a Changing Environment. In The Future of Amazonian Aquatic Biota (pp. 361-396). Cham: Springer Nature Switzerland.
Tavares-Dias, M., Lemos, J. R. G., & Martins, M. L. (2010). Parasitic fauna of eight species of ornamental freshwater fish species from the middle Negro River in the Brazilian Amazon Region. Revista Brasileira de Parasitologia Veterinária, 19, 103-107.
Trust, T. J., Bull, L. M., Currie, B. R., & Buckley, J. T. (1979). Obligate anaerobic bacteria in the gastrointestinal microflora of the grass carp (Ctenopharyngodon idella), goldfish (Carassius auratus), and rainbow trout (Salmo gairdneri). Journal of the Fisheries Board of Canada, 36(10), 1174-1179.
Untergasser, D. (2006). Krankheiten der Aquarienfische (7. Aufl.). S.153-154. Ulmer, Stuttgart, D.
Utsugi, K. (1993). Motility and morphology of sperm of the ayu, Plecoglossus altivelis, at different salinities. Japanese Journal of Ichthyology 40, 273-278.
Vigneault, B., Percot, A., Lafleur, M., & Campbell, P. G. (2000). Permeability changes in model and phytoplankton membranes in the presence of aquatic humic substances. Environmental science & technology, 34(18), 3907-3913.
Watanabe, T., and Takei, Y. (2012). Vigorous SO42- influx via the gills is balanced by enhanced SO42- excretion by the kidney in eels after seawater adaptation. J. Exp. Biol. 215(Pt 10), 1775–1781.
Wetzel, R.G., 1983. Limnology. Saunders College Publication, Philadelphia.
Williams, K. B., Bischof, J., Lee, F. J., Miller, K. A., LaPalme, J. V., Wolfe, B. E., & Levin, M. (2020). Regulation of axial and head patterning during planarian regeneration by a commensal bacterium. Mechanisms of development, 163, 103614.
Wood, C. M., Wilson, P., Bergman, H. L., Bergman, A. N., Laurent, P., Otiang'a-Owiti, G., & Walsh, P. J. (2002). Ionoregulatory strategies and the role of urea in the Magadi tilapia (Alcolapia grahami). Canadian journal of zoology, 80(3), 503-515.
Wood, C. M., Matsuo, A. Y., Wilson, R. W., Gonzalez, R. J., Patrick, M. L., Playle, R. C., & Luis Val, A. (2003). Protection by natural blackwater against disturbances in ion fluxes caused by low pH exposure in freshwater stingrays endemic to the Rio Negro. Physiological and Biochemical Zoology, 76(1), 12-27.
Wood, C. M., Robertson, L. M., Johannsson, O. E., & Val, A. L. (2014). Mechanisms of Na+ uptake, ammonia excretion, and their potential linkage in native Rio Negro tetras (Paracheirodon axelrodi, Hemigrammus rhodostomus, and Moenkhausia diktyota). Journal of Comparative Physiology B, 184(7), 877-890.
Wright, P. A., & Wood, C. M. (2009). A new paradigm for ammonia excretion in aquatic animals: role of Rhesus (Rh) glycoproteins. Journal of Experimental Biology, 212(15), 2303-2312.
Xu, H., Yang, J., Wang, Y., Jiang, Q., Chen, H., & Song, H. (2008). Exposure to 17α-ethynylestradiol impairs reproductive functions of both male and female zebrafish (Danio rerio). Aquatic Toxicology, 88(1), 1-8.
Yamamoto, T. (1961). Physiology of fertilization in fish eggs. International Review of Cytology12, 361-405.
Yanagimachi, R., Kanoh, Y. (1953). Manner of sperm entry in herring egg, with special reference to the role of calcium ions in fertilization. Journal of the Faculty of Science, Hokkaido University 11, 487-494.
Yanagimachi, R., Cherr, G.N., Pilai, M.C., Baldwin, J.D. (1992). Factors controlling sperm entry into the micropyles of salmonid and herring eggs. Development. Growth and Differentiation 34, 447-461.
Žák, J., & Reichard, M. (2020). Fluctuating temperatures extend median lifespan, improve reproduction and reduce growth in turquoise killifish. Experimental gerontology, 140, 111073.
Zanin, L., Tomasi, N., Cesco, S., Varanini, Z., & Pinton, R. (2019). Humic substances contribute to plant iron nutrition acting as chelators and biostimulants. Frontiers in Plant Science, 10, 675.
Zotin, A.I. (1953). Initial stages of the hardening process of salmonid eggs. (in Russian) Doklady Akad. Nauk. S.S.S.R. 89, 573-576.
Zotin, A.I. (1958). The mechanism of hardeing of the salmonid egg membrane after fertilization or spontaneous activation. Journal of Embryology and experimental Morphology 6, 546-568.
